下表是元素周期表的一部分,回答下列有关问题: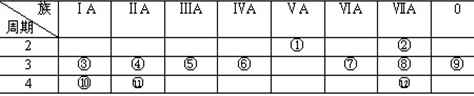
(1)写出下列元素符号:① ,⑥ ,⑦ , 11 。
(2)在这些元素中,最活泼的金属元素是 ,最活泼的非金属元素是 ,最不活泼的元素是 。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 ,
(4)在这些元素中,原子半径最小的是 ,原子半径最大的是 。
已知N2+3H2 2NH3,根据下图判断:
2NH3,根据下图判断:
A是_____________的物质的量浓度变化情况。反应开始时,C(N2)="_____________" ;2min时C(NH3)=_____________________,
0-2min内氢气的平均反应速率v(H2)= ___________________。
(2)一定条件下,可逆反应A2+B2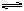 2C达到了化学平衡状态,经测得平衡时C(A2)= 0.5mol/L,C(B2)="0.1mol/L" C(C)=" 1.6" mol/L。若A2、B2、C的起始浓度分别以a mol/L、b mol/L、cmol/L表示,请回答:
2C达到了化学平衡状态,经测得平衡时C(A2)= 0.5mol/L,C(B2)="0.1mol/L" C(C)=" 1.6" mol/L。若A2、B2、C的起始浓度分别以a mol/L、b mol/L、cmol/L表示,请回答:
①a、b应满足的关系是______________。
②a的取值范围是________,说明理由___________________________。
熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26CO32--52e- →34CO2+10H2O。试回答下列问题:
(1)该燃料电池的化学反应方程式为;
(2)正极电极反应式为。
(1)AgNO3的水溶液常温时的pH 7(填“>”、“=”、“<”),原因是:____________________(用离子方程式表示);实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度.以(填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈性,原因是(用离子方程式表示):
_____________________,
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的。
某研究性学习小组用HNO3与大理石反应,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 编号 |
T/K |
大理石规格 |
HNO3浓度 /mol·L-1 |
实验目的 |
| ① |
298 |
粗颗粒 |
2.00[ |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 探究温度对该反应速率的影响; (Ⅲ)实验①和 探究大理石规格(粗、  细)对该反应速率的影响。 细)对该反应速率的影响。 |
| ② |
298] |
|||
| ③ |
308 |
|||
| ④ |
298 |
(2)实验①中CO2的物质的量随时间变化的关系 见图:
见图:
计算在70-90 s范围内HNO3的平均反应速率v(HNO3)=。(忽略溶液体积变化,不需要写出计算过程)。
短周期元素A、B、C、D、E原子序数依次递增,A原子最外层电子数是次外层电子数的2倍,B的单质为双原子分子,其氢化物能使湿润的红色石蕊试纸变蓝,C在同周期元素中原子半径最大,D的最外层电子数等于电子层数,E的最高正价是+7价。
(1)写出E元素在周期表中的位置。
(2)写出A元素气态氢化物的结构式。
(3)B的氢化物和E的氢化物反应所得生成物的电子式为 。
(4)D单质和C的最高价氧化物对应的水化物的溶液反应的离子方程式为。
(5)A单质与B的最高价氧化物对应的水化物的浓溶液反应的化学方程式为 。