甲、乙、丙、丁四种易溶于水的物质,分别由NH+4、Ba2+、Mg2+、H+、OH—、Cl—、HCO-3、SO2-4中的不同阳离子和阴离子各一种组成,将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成,则乙、丙、丁不可能是( )
| A.MgCl2 | B.H2SO4 | C.NH4HCO3 | D.Mg(HCO3)2 |
已知由三种元素构成的四种物质存在下列反应,其中a的分子空间构型为正四面体。组成a分子的两种元素的原子序数和小于10,组成b分子的元素为第三周期的元素。则下列判断正确的是
| A.四种分子中的化学键均是极性键 | B.a、c分子中中心原子均为sp3杂化 |
| C.四种分子中既有σ键,又有π键 | D.b、d分子中共价键的键能b大于d |
已知氨气分子和甲烷分子的空间构型分别为三角锥形和正四面体,造成这一差异的主要原因是
| A.两种分子中心原子的杂化类型不同 |
| B.两种分子中键的极性和分子的极性不同 |
| C.NH3分子中存在有一对未成键的孤对电子 |
| D.氨气分子之间和甲烷分子之间的作用力类型不同 |
下列能达到实验目的的是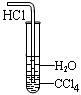

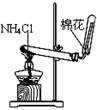

| A.防倒吸 | B.排水法收集NO2 | C.实验室制氨气 | D.除去杂质气体HCl |
下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是
| A.二氧化硅和铜分别受热熔化 |
| B.食盐和酒精分别溶解在水中 |
| C.干冰和氯化铵分别受热变为气体 |
| D.液溴和单质碘分别受热变为气体 |
下列叙述中,正确的是
| A.C60溶于CS2可用相似相溶原理解释 |
| B.两种元素组成的分子中一定只有极性键 |
| C.分子中原子的组成和排列相同则一定是同一种分子 |
| D.冰结构中(如图)每个水分子可以和二个水分子形成氢键 |
