(14分)在氯化银的表面负载银纳米颗粒后将具有优秀的光催化性能,可用于光催化降解污水中的有机污染物。某课题组利用如下流程制备这种光催化剂,并同时获取新型净水剂高铁酸钠。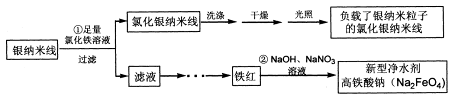
(1)写出①反应的离子方程式______________
(2) 过滤得到氯化银纳米线须洗涤干净后再进行光照。检验氯化银纳米线是否洗净的操作方法是____________________________
(3) 反应②的离子方程式是
(4) 由21.60g银纳米线得到了25.15g最终产物,则产物中银纳米粒子的质量分数是_______。(计算结果保留两位小数)
在下图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂,F是地壳中含量最多的金属元素。(反应中生成的水和部分反应条件未列出)
(1)画出A中阴离子的结构示意图。
(2)反应②在点燃条件下的现象是。
(3)H转化为F的氢氧化物最好选择的试剂是。
(4)反应③的离子方程式为。
(5)反应④的离子方程式为。
综合利用海水可以制备食盐、纯碱、金属镁等物质,其流程如下图所示: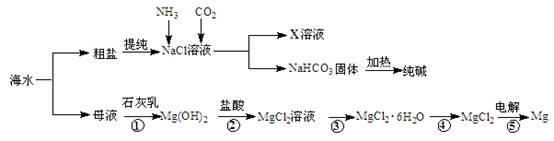
(1)反应①~⑤中,属于氧化还原反应的是(填编号)。
(2)写出反应②的离子方程式。
(3)X溶液中的主要阳离子是Na+和。
(4)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下:
①溶解;②依次加入过量的BaCl2溶液、NaOH溶液、Na2CO3溶液;③;④加适量盐酸;⑤。(请补全缺少的实验步骤)
(5)检验纯碱样品中是否含NaCl应选用的试剂是。
完成下列填空
(1)向煤中加入适量的,可以大大减少燃烧产物中SO2的量。
(2)铝制品具有良好抗腐蚀性的原因是。
(3)在少量的胆矾晶体中加入3 mL浓硫酸,片刻后变白色,证明浓硫酸具有性。
(4)区别氯化铁溶液与氢氧化铁胶体的实验名称是实验。
某学习小组为探究维生素C的组成和有关性质,进行了以下实验:
①取维生素C样品研碎,.称取该试样0.704 g,置于铂舟并放人燃烧管中,不断通入氧气流。用酒精喷灯持续加热样品,样品逐渐消失最后无任何残留物,将生成物(仅有两种物质)先后通过无水硫酸铜和碱石灰,两者分别增重0.288 g和1.056 g,生成物完全被吸收。
②将少许研碎的维生素C样品和适量的紫色石蕊试液充分混合后,溶液颜色变红。
请解答下列问题:
(1)称取的试样中,含有氢原子的物质的量是mo1;碳元素的质最是g。
(2)维生素C中(填“含”、“不含”或“无法确定是否”)有氧元素,理由是根据实验数据可知。
如你回答“含”有,请计算称取的试样中氧原子的物质的量并填入下一空格中;如你回答“不含”等,则下一空格不必填写。称取试样中氧原子的物质的量为mol。
(3)如果要确定维生素C的分子式,你认为还需要知道的信息是。
(4)维生素C和紫色石蕊试液混合后,溶液颜色变红,说明维生素C溶液具有(填“酸”、“碱”或“中”)性。查阅有关资料显示,维生素C具有还原性。请以淀粉溶液、碘水为试剂,写出验证维生素C具有还原性的实验方法和现象:。
已知有机物F 是一种存在于某些植物的果、花等中的天然香料。又知:
是一种存在于某些植物的果、花等中的天然香料。又知:
(i)乙酸酐的结构为 
(ii)同一个碳原子上连有两个羟基通常不稳定,易脱水形成羰基;
(iii)工业上常用有机物G制取有机物F:
某化学小组以有机物A(A是苯的同系物,分子式为C7H8;B中有五种不同化学环境的氢;C可与FeCl3溶液发生显色反应)为原料制取F的合成路线(部分反应条件及副产物已略去)如下:
(1)有机物G中的含氧官能团为和(填官能团名称)。 G的分子式为。
(2)A的化学名称为。由C生成D的反应类型为。
(3)由B生成C的化学方程式为。
(4)写出同时满足下列条件的E的一种同分异构体的结构简式:。
Ⅰ.属于芳香族化合物;Ⅱ.苯环上有两个取代基;Ⅲ.核磁共振氢谱图上有4个吸收峰;IV.能发生银镜反应。
(5)请写出以乙醇(CH3CH20H)为原料制备 (是一种常用的有机溶剂)的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
(是一种常用的有机溶剂)的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: