食盐是日常生活中的必须品,也是重要的化工原料。一同学用某种粗盐进行提纯实验,步骤如图所示。
请回答:
Ⅰ.步骤①和②的操作名称是 (7) ;
Ⅱ.步骤④操作时要用玻璃棒不断搅拌,这是为了防止 (8) 。
Ⅲ.猜想与验证:
| 猜想 |
验证方法 |
实验现象 |
结论 |
| 猜想1: 固体A中含CaCO3 |
取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口。 |
(9) |
猜想1成立 |
| 猜想2: 固体A中含BaCO3 |
取少量固体A于试管中,先滴入 (10) ,再滴入 (11) 溶液。 |
有气泡放出,无白色沉淀 |
(12) |
| 猜想3: 最后制得的NaCl晶体中还含有Na2SO4 |
取少量NaCl晶体于试管中,加适量蒸馏水溶解,再 (13) 。 |
(14) |
猜想3成立 |
Ⅳ. 鉴别NaCl和KNO3溶液的两种方法分别是 (15) ;
(16) 。
某校整理化学药品时,发现如下图所示的两个试剂瓶中分别存放有图1、图2所示的两种银白色金属片(图1所示的金属为X,图2所示的金属为Y )它们到底是哪两种金属呢?
推理和猜想:试剂瓶中的元素符号中含字母“g”的两种常见金属是。
| ①实验步骤 |
②实验现象 |
③结论 |
| 分别把这两种金属放入__ __ ___________溶液中观察 |
金属X的表面有 一层红色物质覆盖 ,金属Y表面无明显变化 |
金属X是 写出有关化学反应方程式: |
根据下列装置图填写有关空格:
|

|
| 比较项目 |
排水法 |
向上排空气法 |
| 收集方法可行性分析 |
CO2气体生成和从水面逸出的速度远大于其溶解和与水反应的速度 |
CO2密度比空气 , 且不与氧气反应 |
| 收集过程分析 |
集满现象 |
验满分析:因气体无色,故集满较难确定,即便用燃着木条移近容器口火焰熄灭,也难证明空气全排尽 |
| 向收集到CO2的集气瓶中倒入等体积适量澄清石灰水,振荡 |
先浑浊后澄清所需时间较短 |
先浑浊后澄清所需时间较长 |
由上述实验可得结论① ;
② 。
(3)用氯化钠固体和水配制100 g 10%的氯化钠溶液,需要用到上图装置中的 (填序号)。若配制后,则所得溶液中氯化钠的质量分数<10%,可能是下列哪些因素造成_______________(填序号)
A、称量时物体与砝码放反了 B、量水时,仰视刻度 C、所用砝码破一角
D、氯化钠中有少量杂质 E、称量后,读数时,天平指针偏右
某同学在做实验时发现盛放NaOH溶液的试剂瓶口与橡皮塞上常有白色粉末出现,为探究这一白色粉末的成分,他做了以下实验:
(1)取少量白色粉末于试管中,再滴加稀HCl,有气泡产生,由此可推出白色粉末中含有。
(2)该同学为进一步探究白色粉末是否含有NaOH,主要操作流程如下: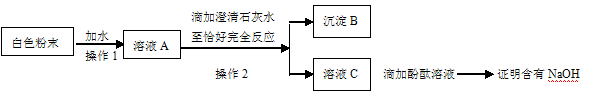
①沉淀B的化学式为。
②在操作1中要用到玻璃棒,其作用是;在操作2中,除要用到铁架台(带铁圈)、烧杯、滤纸、玻璃棒外,还需补充的玻璃仪器是。
③你认为该同学的这个方案是否正确?(填“正确”或“不正确”),
理由是
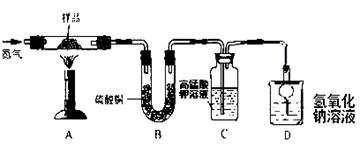
)以下是我们熟悉的实验室制取气体的发生装置、收集装置以及净化装置(装置⑦中碱石灰为固体氢氧化钠和氧化钙的混合物)。请根据装置图回答下列问题:
(1)甲同学在实验室用大理石与稀盐酸反应制取干燥的CO2,应选用的装置组合是。
某学生在上述装置的基础上进行改进,又设计了下图所示的四套装置来制取CO2,其中在制取时不能使反应随时发生或停止的装置为。
(2)实验室用过氧化氢溶液和二氧化锰制取氧气时,过氧化氢溶液应从装置②中的
(填仪器名称)加入,二氧化锰起作用。反应的化学方程式为。
(3)加热固体碳酸氢钠或固体碳酸氢铵都能产生CO2,其方程式分别是:
某同学选用加热碳酸氢钠的办法制取少量的CO2,他不选用碳酸氢铵的理由是。
医学上经常用硫酸亚铁糖衣片给贫血患者补铁.某兴趣小组对这种糖衣片产生了兴趣,打算对药片的糖衣所起作用等问题进行探究.
【提出问题】硫酸亚铁糖衣片中糖衣的作用是什么?
【查阅资料】
(1)亚铁离子遇具有氧化性的物质易被氧化成铁离子;
(2)硫酸亚铁晶体加热会失去结晶水,高温会继续分解产生金属氧化物和非金属氧化物.
【提出猜想】药片糖衣的作用除了包装药物外,还可能是 .
|
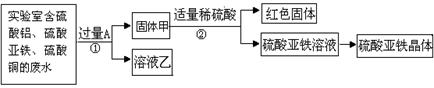
【探究一】利用废水回收铜,制备硫酸亚铁晶体并观察其在空气中的变化推断糖衣的作用.