下图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH 2K2CO3+6H2O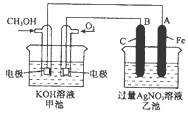
(1)请回答图中甲、乙两池的名称。甲电池是 装置,乙池是 装置。
(2)请回答下列电极的名称:
通入CH3OH的电极名称是 ,
B(石墨)电极的名称是 。
(3)写出电极反应式:
通入O2的电极的电极反应式是 。
A(Fe)电极的电极反应式为 ,
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
I在下图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,酸G是重要的化工产品和化工原料;固体H能溶解在A和酸G且H为良好的耐火材料(图中部分产物没有列出)。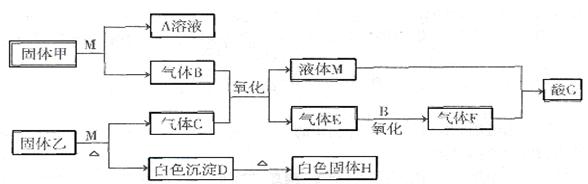
II如图表示的是生产酸G的工业流程: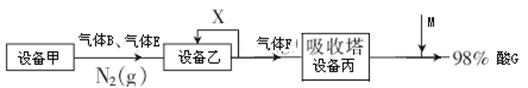
(1)乙设备的名称为固体乙的化学式为M分子的结构式为。
(2)气体X的主要成分为。
(3)写出设备甲中常见的化学反应。
(4)白色沉淀D与G溶液反应的离子方程式为。
(5)将2.24 L(标准状况下)E通入100 mL2 mol/L A的水溶 液后,溶液中离子浓度由大到小的顺序为_______________。
液后,溶液中离子浓度由大到小的顺序为_______________。
(6)电解熔融固体H可制得一种金属,则电解化学方程式为当电解时转移2.4mol电子,制得金属g。
A、B、C、D、E、F是元素周期表中六种短周期元素,请根据表中信息回答下列问题
| 元素 |
A |
B |
C |
D |
E |
F |
性质或结构 信息 |
形成化合物种类最多的元素 |
最高正价是最低负价绝对值的3倍 |
族序数等于周期数的3倍 |
周期数是族序数的3倍 |
地壳中含量最高的金属元素 |
最高价氧化物对应水化物是最强的含氧酸 |
(1)元素B 的离子结构示意图元素F的最高价氧化物的化学式为。
(2)元素A、D分别与元素C 形成原子个数比为1:2的化合物甲和1:1 的化合物乙,则甲属于分子(填“极性”或“非极性”),化合物乙的电子式,甲与乙反应的化学方程式为。
(3)元素B、D组成化合物丙,其晶体类型为,化合物丙的溶液呈(填“酸性”“碱性”或“中性”)。
(4)元素A与氢元素组成的最简单的化合物丁是一种优质燃料,燃烧热值高。
①实验测得,在常温常压下,1g化合物丁完全燃烧生成液态水,放出55.65 kJ 热量。则表示化合物丁的燃烧热的热化学方程式为。
②某实验小组依据丁燃烧的反应原理,设计如右图所示的电池装置。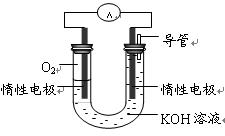
a.该电池正极的电极反应为。
b.工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为。
(5)G也是短周期元素,其核外电子层数与最外层电子数相等,且与E处于元素周期表中对角线位置,它们的单质及其化合物的性质相似,写出G的氧化物与NaOH溶液反应的离子方程式:。若E的氯化物熔沸点较低、易升华,则E的氯化物是化合物(填“离子”或“共价”),试设计一个简单实验证明你的选择。
【化学选修5:有机化学基础】
PET是世界上产量最大的合成纤维,其结构简式为:
现以煤的干馏产品A与F为原料制备PET,生产流程如下图所示。其中A为烃,含碳元素的质量分数为90.6%,其蒸气的密度是空气密度的3.66倍,能使酸性高锰酸钾溶液褪色,但不能使溴水褪色。M分子里所有原子共平面。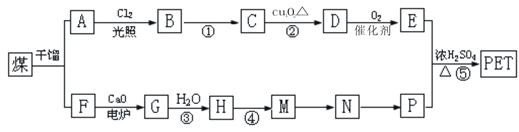
请回答下列问题:
(1)指出下列反应类型:④⑤
(2)指出反应①的反应条件:
(3)写出有机物的结构简式,A:;N:。
(4)写出下列反应的化学方程式:
反应②反应③ 反应⑤
反应⑤
(5)P的一种同系物X分子式为C3H8O2,在核磁共振氢谱图中出现三种信号峰,其峰的强度之比为2︰1︰1。则X的结构简式为。
【化学选修3:物质结构与性质】(15分)
Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增。已知:
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂;
⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。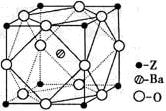
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)化合物M的空间构型为,其中心原子采取杂化;化合物N在固态时的晶体类型为。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为;
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为(写分子式)
(4)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质。该反应的离子方程式为。
(5)Z原子基态时的外围电子排布式为;Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个Z原子等距离且最近的氧原子数为
【化学选修2:化学与技术】(15分)
工业上为了使原料和能量得到充分的利用,常常采用循环操作。
I、利用热化学循环制氢能缓解能源矛盾。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。MnFe2O4的制备: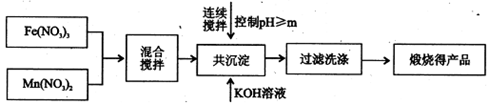
已知Fe3+、Mn2+沉淀的pH如右表所示。
| 开始沉淀 |
完全沉淀 |
|
| Fe3+ |
2.7 |
4.2 |
| Mn2+ |
8.3 |
10.4 |
(1)此工艺中理论上投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比应为。
(2)控制pH的操作中m的值为。
II、用MnFe2O4热化学循环制取氢气: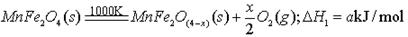
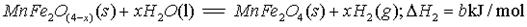
(3)由上可知,H2燃烧的热化学方程式是。
(4)该热化学循环制取氢气的优点是 (填字母编号)。
(填字母编号)。
A.过程简单、无污染 B.物料可循环使用
B.物料可循环使用
C.氧气和氢气在不同步骤生成,安全且易分离
III、工业上可用H2、HCl通过下图的循环流程制取太阳能材料高纯硅。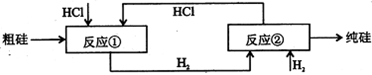
反应①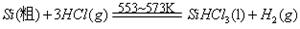
反应②: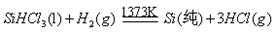
(5)上图中,假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率和反应②中H2的利用率均为75%。则在下一轮次的生产中,需补充投入HCl和H2的体积比是。