按要求完成各题
(1)已知,1mol N2(g)与足量O2(g)起反应,生成2mol NO2(g),吸收68 kJ的热量。该反应的热化学方程式可表示为:
(2)写出下列各物质的电离方程式:
CH3COOH
NH3·H2O  (3)写出下列各物质水解的离子方程式:
(3)写出下列各物质水解的离子方程式:
NaHCO3
AlCl3
(4)把足量的碳酸钙粉末放入水中,建立的溶解平衡可表示为:
实验室常利用甲醛法测定
样品中氮的质量分数,其反应原理为:
[滴定时,1
与 l
相当],然后用
标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I称取样品1.500
。
步骤II将样品溶解后,完全转移到250
容量瓶中,定容,充分摇匀。
步骤Ⅲ移取25.00
样品溶液于250
锥形瓶中,加入10
20%的中性甲醛溶液,摇匀、静置5
后,加入1~2滴酚酞试液,用
标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:①碱式滴定管用蒸馏水洗涤后,直接加入
标准溶液进行滴定,则测得样品中氮的质量分数(填"偏高"、"偏低"或"无影响")。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去
标准溶液的体积(填 "偏大"、"偏小"或"无影响")
③滴定时边滴边摇动锥形瓶,眼睛应观察[]
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由色变成色。
(2)滴定结果如下表所示:
若
标准溶液的浓度为0.1010
则该样品中氮的质量分数为
苯丙酸诺龙是一种兴奋剂,结构简式为
(I)由苯丙酸诺龙的结构推测,它能(填代号)。
a.使溴的四氯化碳溶液褪色 b.使酸性
c.与银氨溶液发生银镜反应 d.与 溶液作用生成
苯丙酸诺龙的一种同分异构体
,在一定条件下可发生下列反应:
据以上信息回答(2)~(4)题:
(2)
的反应类型是。
(3)
的结构简式为。
(4)
的化学方程式是。
根据下面的反应路线及所给给信息填空。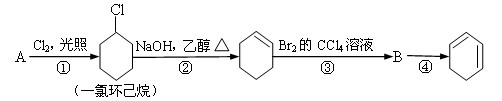
(1)A的结构简式是 ,名称是 。
(2)①的反应类型是 。③的反应类型是 。
(3)反应④的化学方程式是 。
已知溴乙烷跟氰化钠反应后再水解可以得到丙酸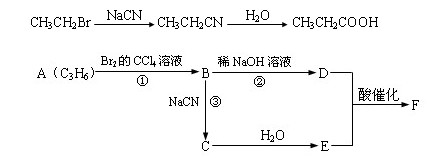
产物分子比原化合物分子多了一个碳原子,增长了碳链。
请根据以下框图回答问题。图中F分子中含有8个原子组成的环状结构。
(1)反应①②③中属于取代反应的是______________(填反应代号)。
(2)写出结构简式:E___________,F______________。
现有常温下的0.1mol·L-1纯碱溶液。
(1)你认为该溶液呈碱性的原因是(用离子方程式表示):①
为证明你的上述观点,请设计一个简单的实验,简述实验过程:②
(2)同学甲认为该溶液中Na2CO3的水解是微弱的,发生水解的CO2-3 离子不超过其总量的10%。请你设计实验证明该同学的观点是否正确。③
(3)同学乙就该溶液中粒子之间的关系写出了下列四个关系式,你认为其中正确的是
④
| A.c(Na+)=2c(CO2-3 ) | B.c(CO2-3 )>c(OH-)>c(HCO-3)>c(H2CO3) |
| C.c(CO2-3 )+c(HCO-3)=0.1mol·L-1 | D.c(OH-)=c(H+)+c(HCO-3)+2c(H2CO3) |