草酸的化学性质与碳酸相似。已知草酸在受热条件下分解,仅生成三种氧化物。某校研究性学习小组对此展开探究:
⑴小刚首先根据草酸中含有氢元素元素,可推测生成物中含有 。
⑵小刚对生成的其他产物进行猜测、验证:
《假设一》生成物中有二氧化碳
实验一:将生成的气体通入澄清的石灰水,实验现象是 ,小明据此判断生成物中含有二氧化碳。
《假设二》生成物中有一氧化碳
实验二:小明用下图装置进行实验,从而证明生成物中含有一氧化碳。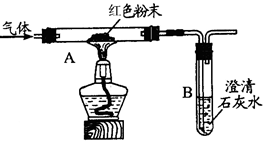
请回答:A装置中红色固体粉末是 (填化学式),A装置中的实验现象是 。
⑶讨论交流:
小芳认为,小明的“实验二”不需要B装置也能够推断出生成物中含有一氧化碳,是否支持小芳的观点: (填“支持”或“不支持”),请说出你的理由 。 小芳认为,从环保的角度看,“实验二”装置有一个缺陷,请你指出该缺陷 ,处理的方法是 。
有下列装置,其中A是气体发生装置,B、C、D、E是气体收集装置,E还可作气体的净化装置(E装置有多个备用)。

(1)当用大理石和盐酸制取
时,选取的收集装置是(填"B"或"C"或"D");为了得到纯净、干燥的
,首先在E装置中注入足量的
溶液来除去
,你认为该方法是否恰当并说明理由,然后在另一个E装置中注入浓硫酸,其作用是。
(2)当用过氧化氢溶液和二氧化锰来制取氧气时,A中发生反应的化学方程式为 ,若a与c相连来收集氧气,还需将装置。
一次性塑料包装袋造成的环境污染已经引起社会的高度关注,许多城市已经开始推广使用纸制食品袋。同学们经查阅资料得知,纸袋的组成成分中一定含有碳元素和氢元素,可能含有氧元素。于是他们利用以下装置进行实验测定。请回答下列问题:
(1)实验中
装置内发生反应的化学方程式为.
(2)实验中选择纯净的氧气而不用空气的原因是.
(3)为分别吸收纸袋充分燃烧的产物,并通过清晰可见的现象检验吸收是否完全,以上实验装置正确的连接顺序是:
→() →()→()→()(填写装置的字母代号)
(4)将实验装置正确连接之后,确认气密性良好。充分燃烧16.2
纸袋样品,测得相关实验数据见右表(假定燃烧产物被完全吸收,灰烬质量忽略不计)。
| 装置 | 实验前装置的质量 | 实验后装置的质量 |
| 200.0 | 200.0 | |
| 210.0 | 234.2 | |
| 220.0 | 229.0 | |
| 210.0 | 212.2 |
通过分析和计算可推断得出,纸袋样品中(填"含"或"不含")氧元素,其碳、氢两种元素的原子个数的最简整数比为。
小刚设计实验探究铁、铜、银三种金属的活动性顺序并分析相关问题。请填空:
(1)他设计的四种实验方案,所需试剂如下:
①铜、银、硫酸亚铁溶液②铁、银、硫酸铜溶液
③银、硫酸亚铁溶液、硫酸铜溶液④铜、硫酸亚铁溶液,硝酸银溶液
上述方案中,正确的是(填写序号)。
(2)某化工厂生产过程中的残液含有硝酸银和硝酸铜两种物质。小刚取少量该残夜,分别盛在
、
两支试管中,再分别加入不同质量的铁粉,充分反应后过滤,分别取滤渣或滤液进行下表所示实验:
| 实验操作 |
实验现象 |
分析与结论 |
| 将
试管滤出的滤渣洗涤后加入到稀盐酸中 |
有气泡产生 |
从 试管得到的滤液中的溶质是 |
| 向
试管得到的滤液中滴加少量稀盐酸 |
有白色沉淀生成 |
试管滤出的滤渣的成分是 |
甲、乙两位同学发现铜质眼镜架上出现一些绿色的锈渍。经查阅资料得知,铜锈的化学成分是碱式碳酸铜
。他们依照钢铁生锈的研究方法设计如下实验(如右图所示):①将光亮铜片部分浸入蒸馏水中;②将光亮铜片究全浸入煮沸过的蒸馏水中;③将光亮铜片放在干燥的空气中。请回答:
(1)推测一段时间后会出现铜锈的是(填写序号)试管内的铜片。
(2)根据上述实验.甲同学认为:铜的锈蚀是铜与水、氧气共同作用的结果。你是否同意他的观点?(填写"是"或"否")
(3)乙同学认为要弄清导致铜锈蚀的因素,还应该再补充一些实验。在补充的实验中,如果要改变的因素.则保持不变的因素是(选取"水"、"氧气"、"二氧化碳"等填写)
小冉和小海两位同学在实验室中进行化学实验。小冉将CO2通入澄清的石灰水中;小海向盛有少量NaOH溶液的试管中滴入几滴酚酞溶液,再倒入一定量的稀盐酸。
(1)小冉同学观察到的现象,该反应的化学方程式为;
(2)小海同学实验后发现试管内溶液为无色,认为氢氧化钠和盐酸恰好完全反应.你认为他的观点是否正确(填“是”或“否”),你的理由是:
;
(3)实验结束后,两名同学将反应后的剩余物同时倒入废液缸中,发现有气泡产生,废液仍然为无色。请你和两名同学一起对废液缸中废液的组成进行探究。
【提出问豫】废液中的溶质除指示剂外,还有什么?
【进行猜想】①两位同学一致认为溶质为CaCl2和NaCl:
②你认为溶质的组成还可能为。
【实验验证】向废液中加入,出现现象。
【实验结论】说明猜想(填①或②)正确。
【实验反思】为减少废液对环境的污染,可采取的方法是。
【拓展延伸】通过酚酞溶液由红色变无色,说明NaOH已与盐酸完全反应,你认为还可以向反应后的溶液中加入(不使用紫色石蕊试液和pH试纸)来证明NaOH确已完全反应。