检验SO2气体中是否存在CO2气体,应采用的方法是( )
| A.通过澄清石灰水 |
| B.先通过小苏打(NaHCO3)溶液,再通过石灰水 |
| C.先通过足量酸性高锰酸钾溶液,再通过石灰水 |
| D.通过品红溶液 |
碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的以碘离子形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下: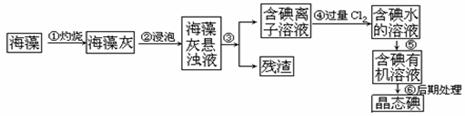
(1)指出上述提取碘的过程中有关实验操作的名称:步骤③_________,步骤⑤____________
(2)写出步骤④对应反应的离子方程式 _____________________________
(3)步骤④中若不用氯气,可以选择滴加稀硫酸,再加入H2O2,则反应的离子方程式________
(4)提取碘的过程中,可选择的有机试剂是_______________
| A.酒精 | B.醋酸 | C.四氯化碳 | D.苯 |
(5)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网、以及必要的夹持仪器和物品,尚缺少的两种玻璃仪器是____________________________________________
(6)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图实验装置中存在的错误之处(1处):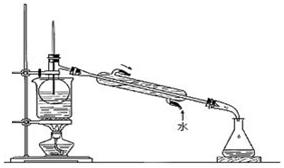
(7)请设计出一种检验提取碘后的水溶液中是否还含有单质碘的简单方法。
化学上常用燃烧法确定有机物的组成。下图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品。根据产物的质量确定有机物的组成。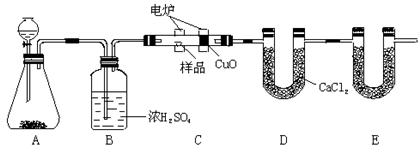
回答下列问题:
(1)A装置中分液漏斗盛放的物质是,写出有关反应的化学方程式:。
(2)C装置(燃烧管)中CuO的作用是。
(3)写出E装置中所盛放物质的名称,它的作用是。
(4)若准确称取1.20g样品(只含C、H、O三种元素中的两种或三种)。经充分燃烧后,E管质量增加1.76g,D管质量增加0.72g,则该有机物的最简式为。
(21分) “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题: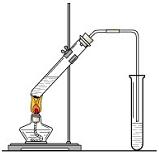
(1)写出制取乙酸乙酯的化学反应方程式
(2)饱和碳酸钠溶液的主要作用是、、。
(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是 。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(5)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 。
硫酸铜是一种应用极其广泛的化工原料。制备硫酸铜是无机化学实验教学中一个重要的实验。由于铜不能与稀硫酸直接反应,实验中将浓硝酸分次加入到铜粉与稀硫酸中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)。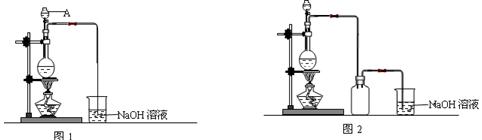
(1)图1中,A仪器的名称为,烧瓶中发生的离子反应方程式为。
(2)图2是图1的改进装置,改进的目的是。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加FeSO4或Fe2(SO4)3,反应完全后,向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,滤渣作催化剂循环使用。(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4。)
请回答下列问题:
①方案1中的B仪器名称是。
②方案2中甲物质是(填字母序号)。a、CaOb、CuCO3 c、CaCO3
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol/L的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h后,升温到60℃,持续反应1 h后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.6g。请回答下列问题:
③该反应的离子反应方程式为。
④控制温度在50℃和60℃加热的原因为,晶体采用酒精淋洗的优点是。
⑤上述两种氧化法中,更符合绿色化学理念的是(填“第一组”或“第二组”),理由是。
文献资料显示,草木灰主要含有不溶性杂质及K2CO3,还含有少量KCl、K2SO4等。某化学兴趣小组拟测定草木灰中钾盐的含量及钾盐中K2CO3的含量。
测定草木灰中钾盐含量
(1)该实验的主要步骤顺序为:称量→→→→ →冷却→再称量(填字母序号)
A. 溶解 B.过滤 C、洗涤、烘干 D、蒸发
(2)称量前,在调整托盘天平的零点时,若指针偏向右边,应将右边的螺丝向(填左、右)旋动。某学生称量时,在天平右盘加上规定质量的砝码后,在左盘的小烧杯中加入样品,此时指针稍偏右边,该学生的操作应为。
(3)实验中A、B、C、D三步操作均使用了玻璃棒,操作B中玻璃棒的作用是,操作D用玻璃棒不断搅动的原因。
测定钾盐中K2CO3含量
(4)取上述操作中所得的钾盐,配成稀溶液,加入CaCl2溶液使CO32-生成沉淀,过滤得到碳酸钙沉淀后,用蒸馏水多次洗涤,烘干、称量、计算。检验沉淀是否完全的方法是,检验沉淀是否洗净的方法是。