(1)稀有气体不能形成双原子分子是因为 。
(2)多电子原子中,在离核较近的区域内运动的电子能量 (填较高或较低)。
(3)不含中子的核素的核组成符号为 。
(4)ⅥA族氢化物中沸点最低的是 (写化学式)。
(5)在金属元素与非金属元素的分界线附近可以寻找制备 材料的元素;在
中可寻找制备催化剂及耐高温、耐腐蚀的元素。
(6)下列选项中,随原子序数递增而呈周期性变化的是 (填序号,后同);其中,起决定性作用的是
A.原子核外电子排布,B.原子半径,C.主要化合价,D.元素的金属性或非金属性。
(7)下列核素中,用于考古时测文物年代的是 (填序号)。
A.2H和3H, B.14C, C.235U。
(8)下列实验中,可产生白烟的是 (填序号)。
A.氢气与氯气反应,B钠与氯气反应。
(9)下列反应中,更剧烈的是 (填序号)。
A.钠与水反应,B.钾与水反应。
(10)取下列溶液分装两试管,再分别依次加入少量氯水和少量四氯化碳,用力振荡、静置后,四氯化碳层显橙红色的是 (填序号)。
A.溴化钠溶液,B.碘化钾溶液。
(11)用电子式表示MgCl2的形成过程 。
认真观察下列装置,回答下列问题: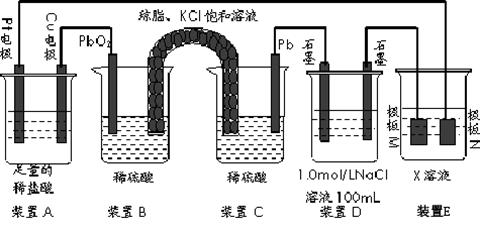
(1)装置B中PbO2上发生的电极反应方程式为。
(2)装置A中总反应的离子方程式为。
(3)若装置E中的目的是在Cu材料上镀银,则极板N的材料为。
若装置E的目的是验证金属的电化学防腐,则极板N的材料为__________________ 。
(4)当装置A中Cu电极质量改变6.4g时,装置D中产生的气体体积为L(标准状况下)。
一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,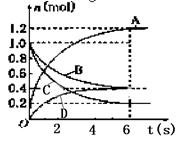
请回答下列问题:
(1)写出该反应的化学方程式:。
(2)0-6 s内,B的平均反应速率为:。
(3)下列说法正确的是()
A.反应进行到1 s时,v(A)=v(D)
B.反应进行到6 s时,各物质的反应速率相等
C.反应进行到6 s时反应停止。
D.当反应达到平衡状态时4v(A)=5v(C)
(1)家用液化石油气的主要成分之一是丁烷(C4H10),当10 kg丁烷完全燃烧并生成二氧化碳气体和液态水时,放出的热量为5×105 kJ。试写出丁烷燃烧的热化学方程式:。已知1mol液态水汽化时需要吸收44 kJ热量,则反应C4H10(g)+6.5O2(g) ===4CO2(g)+5H2O(g)的ΔH=。
(2)有同学用丁烷与空气为原料制作一燃烧电池,若以稀硫酸为电解质溶液时,其负极反应式为。
(3)已知拆开1 mol H-H键,1 molN-H键,1 molN≡N键分别需要的能量是akJ、bkJ、ckJ,则N2与H2反应生成NH3的热化学方程式为。
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示装置模拟工业制取并收集ClO2。
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、;B也必须添加温度控制装置,应该是(选填“冰水浴”或“热水浴”)装置。
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据下图所示的NaClO2的溶解度曲线,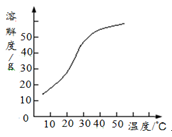
请补充从NaClO2溶液中制得NaClO2的操作步骤:①;②;③洗涤;④干燥。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol·L—1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知2 Na2S2O3 + I2= Na2S4O6 + 2NaI)
①滴定过程中,至少须进行两次平行测定的原因是。
②原ClO2溶液的浓度为g / L(用步骤中的字母代数式表示)。
通过煤的气化和液化,使碳及其化合物得以广泛应用。
I.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向1L恒容密闭容器中充人CO和H2O(g),800℃时测得部分数据如下表。
| t/min |
0 |
1 |
2 |
3 |
4 |
| n(H2O)/mol |
0.600 |
0.520 |
0.450 |
0.350 |
0.350 |
| n(CO)/mol |
0.400 |
0.320 |
0.250 |
0.150 |
0.150 |
则该温度下反应的平衡常数K=。
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1 H2,
此时υ(正)υ(逆) (填“>” “="”" 或 “<”)。
II.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283 kJ·mol-1、286 kJ·mol-1、726 kJ·mol-1'。
(3)利用CO、H2合成液态甲醇的热化学方程式为。
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响。
III。为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示: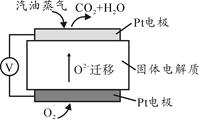
一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2—。
(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式。
(6)已知一个电子的电量是1.602×10—19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOHg。
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一。
(7)将CO2转化成有机物可有效地实现碳循环。如:
a.6CO2+6H2O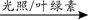 C6H12O6+6O2
C6H12O6+6O2
b.2CO2 + 6H2 C2H5OH +3H2O
C2H5OH +3H2O
c.CO2 + CH4 CH3COOH
CH3COOH
d.2CO2 + 6H2 CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
以上反应中,最节能的是,反应c中理论上原子利用率为。