下列有关元素周期律的叙述中,正确的是 ( )
| A.非金属性强弱:F2<Cl2 | B.金属性强弱:K<Na |
| C.酸性强弱:H2SO4<HClO4 | D.碱性强弱:NaOH<Mg(OH)2 |
在日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的碘、铁、钙、硒、氟应理解为 ( )
| A.元素 | B.单质 | C.分子 | D.氧化物 |
通常用于衡量一个国家石油化工发展水平的标志是 ( )
| A.石油的产量 | B.乙烯的产量 | C.天然气的产量 | D.硫酸的产量 |
考古学上常用碳元素的一种核素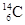 来测定文物的历史年代。下列关于
来测定文物的历史年代。下列关于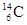 的叙述中,错误的是
的叙述中,错误的是
| A.质子数是6 | B.核外电子数是6 | C.中子数是6 | D.质量数是14 |
19世纪,初步发现元素周期律并发明元素周期表的科学家是 ( )
| A.舍勒 | B.道尔顿 | C.拉瓦锡 | D.门捷列夫 |
1.76 g铜镁合金完全溶解于50 mL、密度为1.40 g/cm3、质量分数为63%的浓硝酸中,得到NO2气体1792 mL。(标准状况),向反应后的溶液中加入适量的1.0 mol/LNaOH溶液,恰好使溶液中的金属离子全部沉淀。下列说法不正确的是
| A.加入NaOH溶液的体积是50 mL |
| B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| C.浓硝酸在与合金反应中起了酸性和氧化性的双重作用,且起氧化性的硝酸的物质的量为0. 08 mol |
| D.得到的金属氢氧化物沉淀的质量为3. 12 g |