15分)普通纸张的成分是纤维素,在早期的纸张生产中,常采用纸表面涂敷明矾的工艺,以填补其表面的微孔,防止墨迹扩散,请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存。经分析检验,发现酸性腐蚀主要与造纸中涂敷明矾的工艺有关,其中的化学原理是______。为防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的化学(离子)方程式为______。
(2)为了保护这些纸质文物,有人建议采取下列措施:
①喷洒碱性溶液,如稀氢氧化钠溶液或氨水等,这样操作产生的主要问题是______。
②喷洒Zn(C2H5)2。Zn(C2H5)2可以与水反应生成氧化锌和乙烷。用化学(离子)方程式表示该方法生成氧化锌及防止酸性腐蚀的原理______。
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾,钛白粉的一种工业制法是以钛铁矿主要成分(FeTiO3)为原料按下过程进行的,请完成下列化学方程式
2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霆形成的原因。
(1)汽车尾气净化的主要原理为; , 在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态。
, 在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态。
①能判断该反应达到平衡状态的标志是。
| A.在单位时间内生成1molCO2的同时消耗了lmolCO |
| B.混合气体的密度不再改变 |
| C.混合气体的平均相对分子质量不再改变 |
| D.混合气体的压强不再变化 |
②在t2时刻,将容器的容积迅速扩大到原来的2倍, 在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在右图中补充画出从t2 到t4时刻正反应速率随时间的变化曲线: 
(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应为:
①该反应在下能自发进行(填“高温”或“低温”)。
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为。(已知: ;
; 。
。 ;
;  。)
。)
(3)已知反应: ,现将不同量的CO(g)和H20(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
,现将不同量的CO(g)和H20(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据: 
①实验1条件下平衡常数K=(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是。
③该反应的 0(填“<”或“>”);
0(填“<”或“>”);
乙醇在能源、生产及日常生活等许多方面都有十分广泛的应用。请计算:
(1)将足量乙醇与9.2 g金属钠充分反应,则标准状况下生成气体的体积是L
(2)若一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物依次经过浓硫酸和碱石灰使其被充分吸收,浓硫酸增重10.8 g,碱石灰增重13.2 g。则氧气的物质的量是mol,燃烧产物的平均摩尔质量是g/mol。
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是(填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(2)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□。
②Ⅱ中转化的基本反应类型是,该反应过程能析出KClO3晶体而无其它晶体析出的原因是。
(3)一定条件,在水溶液中1 mol Cl-、ClOX-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。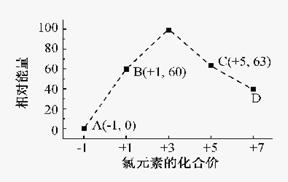
①D是(填离子符号)。
②B→A+C反应的离子方程式为;生成1molC时,KJ的热(填吸收或放出以及具体数值)
已知:A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成食品包装材料。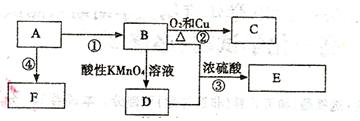
(1)A的结构简式为。
(2)D分子中的官能团是,
(3)写出下列反应的化学方程式
②④
酸奶中含有乳酸。乳酸在常温常压下是一种无色的黏度很大的液体。取9.0g乳酸与足量的Na反应,在标准状况下可收集到2.24L气体。另取9.0g乳酸与足量的NaHCO3反应,生成的CO2气体在标准状况下体积为2.24L。已知乳酸分子中含有一个甲基,则由上述条件可以确定
(1)乳酸的相对分子质量为。
(2)乳酸与NaHCO3反应的化学方程式为。
(3)在浓H2SO4存在下,两分子乳酸相互反应生成环状酯类化合物,环状酯的结构简式为。