元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(2)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液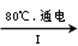 NaClO3溶液
NaClO3溶液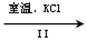 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②Ⅱ中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(3)一定条件,在水溶液中1 mol Cl-、ClOX-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。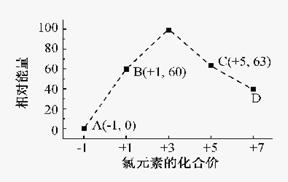
①D是 (填离子符号)。
②B→A+C反应的离子方程式为 ;生成1molC时, KJ的热(填吸收或放出以及具体数值)
化学科学在药物的开发、合成和使用中起着至关重要的作用。如小苏打、氢氧化铝、三硅酸镁等可治疗胃酸过多,硫酸亚铁可补铁、防治贫血。试回答下列问题:
(1)写出小苏打与胃酸(主要成分为稀盐酸)作用的离子方程式:。
(2)现有一瓶胃舒平药片(复方氢氧化铝),请设计实验验证其主要成分。(写出实验步骤和实验现象):
将药片碾碎,,则说明其主要成分为氢氧化铝。
(3)自选合适的氧化剂,将补铁剂中的Fe2+氧化成Fe3+,写出相关的离子反应方程式:_________________ ______。
检验Fe3+常用的试剂除碱外,还可以用(填化学式),现象是。
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为;漂白粉的有效成分是(填化学式)。该反应中氧化剂与还原剂物质的量之比是 __________。
有机物A的结构简式为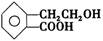 ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。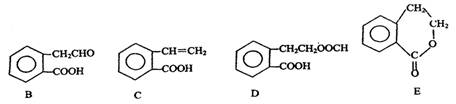
请回答下列问题:
(1)指出反应的类型:A→C:。
(2)在A~E五种物质中,互为同分异构体的是(填代号)。
(3)写出由A生成B的化学方程式
(4)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是(填序号)。
(5)C能形成高聚物,该高聚物的结构简式为。
(6)写出D与NaOH溶液共热反应的化学方程式
。
(13分) 通常情况下,多个羟基连在同一个碳原子上的分子结构是不稳定的,容易自动失水,生成碳氧双键的结构:
下面是9种化合物的转变关系:
(1)化合物①的结构简式,它跟氯气发生反应的条件A是。
(2)化合物⑤跟⑦可在酸的催化作用下去水生成化合物⑨,⑨的结构简式是,名称是。
(3)③→⑥的化学反应方程式是。
(4)化合物⑨是重要的定香剂,香料工业上常用化合物②和⑧直接合成它,此反应的化学反应方程式是 _________________________________________。
请同学们根据官能团的不同对下列有机物进行分类。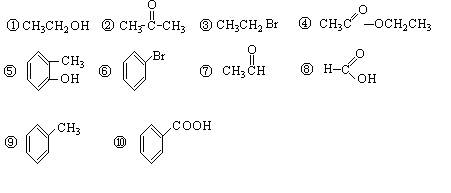
(1)芳香烃:;(2)卤代烃:(3)醇:;(4)酚:;(5)醛:;(6)酯:。