铝制品在日常生活中应用广泛,但铝制品却不宜长时间盛放腌制食品。资料显示:"铝制品表面虽然有一层致密的氧化膜保护……氯化钠也会破坏氧化膜的结构,加速铝制品的腐蚀。"
《提出问题》氯化钠溶液中的哪一种离子对氧化膜产生了破坏作用?
《实验方案》
| 实验序号 |
实验1 |
实验2 |
实验3 |
| 方 案 |
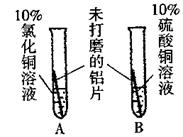 |
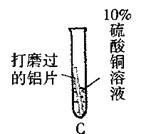 |
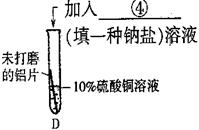 |
| 现 象 |
A中铝片表面有红色固体析出;B中铝片无明显现象。 |
② |
与A中的现象相同 |
| 结 论 |
溶液中对氧化膜产生了破坏作用的离子可能是 ① |
除去表面氧化膜的铝片会与CuSO4溶液反应。该反应的化学方程式③ |
验证了实验1的结论。 |
《反思》针对实验3,莹莹认为还应增做一个对比实验,她的方案是向 试管中再加入 溶液,结果无明显现象。该实验可证明溶液中对氧化膜不产生破坏作用的离子是
⑤
(10,威海12)有三种失去标签的溶质质量分数分别为15%、l0%和5%的盐酸溶液。限定你选择下列仪器和药品,设计两种不局的实验方案,辨别出最浓的和最稀的盐酸溶液。
实验仪器:精密温度计、剪刀、镊子、量筒、秒表、烧杯、大试管、胶头滴管。
药品:镁条
提示:①镁条和盐酸反应速度很快,通过观察放出气泡速度很难准确判断盐酸浓度的大小,所以不建议用这种方法辨别之。②当你设计一种方案时,不必用到所有的仪器。③在描述每种实验方案时,要求说明:观察或测定何种变量、需要控制的条件、选用的仪器、实验步骤及结果与推论。
(1)实验知识和技能准备:
用量筒量取一定体积的液体时,正确的操作方法是___________________________________________
______________________________________________________________________________________________________________________________________________________________________________________
向试管中加入块状固体药品的方法是_______________________________________________________
___________________________________________________________________________________________
(2)把你设计的实验方案依次填写在下表中.
实验方案一:
| 你观察或 测定的量 |
需要控制 的实验条件 |
选用的 仪器 |
实验步骤 |
结果与推论 |
实验方案二:
| 你观察或 测定的量 |
需要控制 的实验条件 |
选用的 仪器 |
实验步骤 |
结果与推论 |
(3)为了排除实验过程中偶然因素的干扰,保证实验结果的可靠性,你认为还应该如何完善你的实验方案?
___________________________________________________________________________________________
(10南通24).在师生联谊晚会上,化学老师表演了“吹气生火”的魔术。用棉花将一种淡黄色的固体包裹其中,将一根长玻璃管插入棉花团中吹气,稍后棉花团剧烈燃烧起来。同学们为了揭开这个魔术的秘密,进行了如下探究。
【相关信息】①淡黄色固体成分是过氧化钠(Na2O2)。
②吹出的气体主要成分有氮气、二氧化碳和水蒸气。
③过氧化钠与氮气不反应。
④碳酸钠溶液呈碱性。
【分析讨论】根据棉花团剧烈燃烧的现象分析,反应中除了生成氧气外,还说明过氧化钠发生的反应是▲(填“吸热”或“放热”)反应。
【提出猜想】同学们发现残留固体呈白色,对该固体成分进行猜想:
猜想Ⅰ:固体成分是Na2CO3, CO2参加反应。
猜想Ⅱ:固体成分是NaOH, H2O参加反应。
猜想Ⅲ:固体成分是▲,CO2和H2O均参加反应。
【实验探究】同学们在老师带领下用足量且潮湿的CO2气体通入过氧化钠粉末中,充分反应后,取白色固体于试管中配成溶液,设计实验对猜想进行验证。
验证Ⅰ:向溶液中滴加稀盐酸,发现有气泡产生。有同学认为固体成分仅含有Na2CO3。
验证Ⅱ:蘸取少量溶液滴到pH试纸上,与标准比色卡比较,pH大于7,有同学认为固体是NaOH。请问此结论是否正确?▲(填“正确”或“错误”),原因是:▲。
验证Ⅲ:先向溶液中加入足量的▲溶液,看到白色沉淀产生,写出反应方程式▲;然后向上层清液中加入▲溶液,看到溶液呈红色,验证了猜想Ⅲ是正确的。
【实验反思】由验证Ⅲ的结果可知,验证Ⅰ的结论错误,因为它不能排除▲的存在。
【拓展延伸】根据探究所获得的知识,有同学认为可以用过氧化钠做“滴水生火”的魔术,从燃烧的要素考虑,你认为要使魔术成功必须控制 ▲的用量。
(10常州28).过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用,某化学研究性学习小组设计并完成了如下实验。
【实验目的】测定过碳酸钠样品(含有的杂质不溶于水且不与酸反应)的纯度。
【实验原理】2Na2CO4 + 4HCl ="====" 4NaCl + 2CO2↑+ O2↑+ 2H2O
【实验装置】
【交流与讨论】
Ⅰ.甲同学认为测定产物中O2的体积即可测定样品的纯度。
(1)装置②的作用是:▲;
(2)装置③的作用是:▲;
(3)称取适量样品与足量浓盐酸充分反应后,收集到的氧气的体积为0.25 L(已知该实验条件下氧气的密度为1.28g/L),则称取的样品质量应大于▲g;
Ⅱ.乙同学认为测定产物中CO2的质量(即反应前后装置②的质量差)就可测定样品的纯度。但利用上述实验装置测得CO2的质量并计算样品的纯度,结果会偏高,你认为原因可能是▲;(填序号)
A.浓盐酸易挥发,产生的氯化氢气体被装置②吸收
B.二氧化碳气体逸出时带出的水蒸气在装置②中冷凝而被吸收
C.装置①、②内空气中的二氧化碳被装置②吸收
Ⅲ.丙同学提出了一种新方案,得到了大家的一致认可:称取样品12.5g,滴加足量浓盐酸至样品反应完全,再将烧瓶中所有的液体蒸发、结晶、烘干,称得氯化钠固体11.7 g。则该样品的纯度为▲。
(10盐城2. 18).(1)请回答下列有关水的问题:
①自来水生产过程中先用的方法除去水中不溶性杂质,再进行消毒。X是一种常见的自来水消毒剂,工业上制取X的化学方程式为: Cl2+2NaClO2=2NaCl+2X,则X的化学式是▲。
②地下水硬度过大会影响生产和生活,应软化后使用。
a.检验硬水常用的是物质是。
b.如果某地地下水钙、镁离子含量过高(假设主要以CaCl2、MgCl2形式存在),可先加入适量的熟石灰,反应的化学方程式为▲,再加入适量的纯碱后生成沉淀,即可将水软化。
③我市不少村镇小型河沟中藻类疯长,说明水体富营养化,你认为造成该现象的原因可能有▲(正确选项有多个,请选填字母序号)。
A.化学肥料流失到河中 B.排放的生活污水中有含磷洗涤剂
C.人畜的粪便流失到河中 D.工业废水的排放
④爱护水资源从我做起,下列做法可行的有▲(正确选项有多个,请选填字母序号)。
A.洗脸、刷牙时随时关闭水龙头 B.用洗菜、洗衣的水冲厕所、拖地
C.用洗衣机洗一两件衬衫 D.用残茶水浇灌某些花卉
(2)有机物A在氧气中燃烧后只生成二氧化碳和水,为确定A的组成,某同学进行了如下探究。
【猜想】
猜想一:A中只含C、H两种元素
猜想二:A中含C、H、O三种元素
【实验】
【结论】猜想▲正确(选填“一”或“二”)。
【反思】有机物A中所含元素的质量比为▲。
(10汕头23)(14分)2010年4月28日某媒体题为“排污工程施工,毒气放倒三人”的报道,引起某兴趣小组同学的思考。
【提出问题】排污管道中的毒气有什么成分?
【查阅资料】
I.排污管道中的大部分有机物在一定条件下发酵会产生CO、CO2、H2S、CH4等。
Ⅱ.H2S气体能与CuSO4溶液反应生成黑色沉淀。
【提出猜想】小组同学对排污管道气含有上述气体中最少3种成分的猜想如下:
猜想1:有CO、CO2、H2S;猜想2:有CO、CO2、CH4;
猜想3:有CO、H2S、CH4;猜想4:有CO2、H2S、;
猜想5:有CO、CO2、H2S、CH4。
【实验方案】小组同学共同设计了下图所示的装置并进行探究(夹持仪器已省略)。
【问题讨论】
(1)如果A装置没有明显变化,则猜想成立;
如果B装置没有明显变化,则猜想成立。
(2)在验证猜想l的实验中,装置C中NaOH溶液的作用是;若要进一步验证气体燃烧后的产物,操作是:迅速把烧杯倒过来,向烧杯内注入 ,振荡。(3)要确证猜想5中是否有CH4,某同学认为图示装置有不足之处,需要在装置C与D之间加一个装置。改进后,若气体燃烧,且D装置内壁出现,证明气体中一定含有CH4。
为了进一步确定气体中是否含有CO,可分别测定燃烧产物中H2O、CO2的质量。其方法是:将燃烧产物依次通过盛有、的装置,分别称量吸收燃烧产物前、吸收燃烧产物后装置的质量,通过计算、分析得出结论。