在一定温度下的2 L密闭容器中充入0.4 mol SO2和0.2 mol O2 ,发生反应:2SO2(g)+O2(g)  2SO3(g) ΔH <0,n(O2)随时间的变化如图实线所示:
2SO3(g) ΔH <0,n(O2)随时间的变化如图实线所示:
(1)用SO2表示0~4 min内该反应的平均速率为 。该温度下反应的平衡常数K为 。升高温度K值 (填“增大”、“不变”或“减小”)。
(2)若温度不变,在容器中再加1 mol O2 ,重新达到平衡,则SO2的平衡浓度
(填“增大”、“不变”或“减小”),氧气的转化率 (填“升高”、“不变”或“降低”),SO3的体积分数 (填“增大”、“不变”或“减小”)。
(3)仅改变某一实验条件再进行两次实验,测得O2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是_____________________________,曲线II对应的实验条件改变是______________________________________。
物质的量浓度均为0.1mol/L的下列溶液:①KNO3 、②Na2CO3 、③NaHCO3 、④NaHSO4 、⑤CH3COOH、⑥NaOH、⑦Ba(OH)2 、⑧NH4Cl,pH由大到小的顺序为:
(填数字代号)
下列盐溶液中能发生水解的用离子方程式表示,不能发生水解的请写上“不发生水解”字样并说明溶液的酸碱性:
1)CH3COOK ,溶液呈性;
2)K2SO4,溶液呈性;
3)CuCl2,溶液呈性。
下列物质的分子中,所有的原子都在同一平面上的是
| A.NH3 | B.C3H4 | C.甲烷 | D.乙烯 |
(1)CH3+.CH3-.CH3-都是重要的有机反应中间体,有关它们的说法正确的是。
| A.它们均由甲烷去掉一个氢原子所得 |
| B.它们互为等电子体,碳原子均采取sp2杂化 |
| C.CH3-与NH3.H3O+互为等电子体,几何构型均为三角锥形 |
| D.CH3+中的碳原子采取sp2杂化,所有原子均共面 |
E.两个CH3-或一个CH3+和CH3-结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①指出锌在周期表中的位置:周期,族,区。
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式;葡萄糖分子中碳原子杂化方式有。
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键。
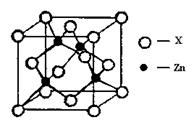
④右上图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为;该化合物的晶体熔点比干冰高得多,原因是。
2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2).导电乙炔黑(一种炭黑).铝箔以及有机粘接剂。某回收工艺流程如下:
(1)上述工艺回收到的产物有。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是_______________。
(3)碱浸时主要反应的离子方程式为_____________________。
(4)酸浸时反应的化学方程式为___________。如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是_______________。
(5)生成Li2CO3的化学反应方程式为____________。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应____________。