(1)、配制FeSO4溶液时,常加入少量铁粉,目的是___________________________________;常加入少量H2SO4,目的是__________________________________________________。
(2)、泡沫灭火剂包括Al2(SO4)3溶液(约1 mol·L-1)、NaHCO3溶液(约1 mol·L-1)及起泡剂。使用时发生的化学反应的离子方程式是_____________________________。
(3)、已知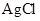 为难溶于水和酸的白色固体,
为难溶于水和酸的白色固体,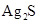 为难溶于水和酸是黑色固体。
为难溶于水和酸是黑色固体。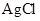 和
和
水的悬浊液中加入足量的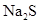 溶液并振荡,结果白色固体完全转化为黑色固体。
溶液并振荡,结果白色固体完全转化为黑色固体。
①、写出白色固体转化黑色固体的化学方程式: ;
②、白色固体转化成黑色固体的原因是: 。
(4)、已知下列物质在20℃下的Ksp如下,试回答下列问题:
| 化学式 |
① AgCl |
② AgBr |
③ Ag2S |
④ Ag2CrO4 |
| Ksp |
2.0×10-10 |
5.4×10-13 |
2.0×10-48 |
2.0×10-12 |
①20℃时,上述四种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是(填序号)
_____________________________。
②向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,=_______________ 。
(1)有浓度均为0.1 mol•L-1的 ①盐酸 ②硫酸 ③醋酸三种溶液,请用序号填空: 三种溶液的c(H+)大小顺序为 ;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次的大小关系为 ;若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,此时三种溶液的pH的大小关系为 。
(2)25℃时,AgCl的Ksp=1.8×10-10 ,试写出AgCl溶解平衡的表达式: ,现将足量AgCl固体投入100mL0.1mol/L MgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)= mol/L(忽略溶液体积的变化)。
(1)下列有关硅单质及其化合物的说法正确的是 。
A.高纯度的硅单质广泛用于制作光导纤维
B.水泥、玻璃、陶瓷都是硅酸盐产品
C.自然界中的硅元素储量丰富,并存在大量的硅单质
D.SiO2属于酸性氧化物,故只与碱溶液发生化学反应,不与任何酸反应
(2)某些化学反应可用下式表示(未配平):A+B→C+D+H2O,请回答下列问题:
①若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,D具漂白性。
A. 写出该反应的离子方程式: 。
B. Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备: MgCl2+2NaClO3=Mg(ClO3)2+2NaCl
MgCl2+2NaClO3=Mg(ClO3)2+2NaCl ,已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
,已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:


将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因: 。
②若A与B加热生成的产物C、D均为无色气体,且C、D两分子中组成元素的原子个数比都为1:2,则符合上式的化学方程式是: 。
③若A为过氧化钠,B为硫酸,则C、D的化学式为 、 。
化合物A只由两种非金属元素组成,A不稳定,一定条件下爆炸生成B、C,以下为相关物质的转化关系,其中B、C、D、J为单质,其中B、D为空气的主要成分,只有J为固体,E为红棕色氧化物固体,反应①、②都是工业生产上的重要反应(部分生成物略),④反应中K过量。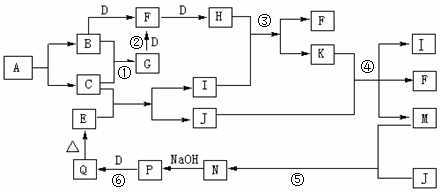
(1)写出反应②的化学反应方程式 。
(2)G的水溶液呈碱性的原因是 。
(3)标况下,将集满H气体的试管倒扣于水槽中,充分反应后所得溶液的物质的量浓度为 。
(4)P→Q反应过程中会观察到的实验现象为 。
(5)如何检验M溶液中阳离子 。
(6)M溶液在强碱性环境下可被KClO溶液氧化制得K2JO4试着写出该反应的离子方程式: 。
在人类社会的发展进程中,金属起着重要的作用。
(1)以下有关金属单质的叙述正确的是。
A.金属钠非常活泼,在实验室中保存在石蜡油或煤油中
B.用坩埚钳夹住一小块铝箔,在酒精灯上加热,可观察到铝箔熔化,并有熔融物滴下
C.铁单质与水蒸气反应的化学方程式为:2Fe+3H2O(g) Fe2O3+3H2
Fe2O3+3H2
(2)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。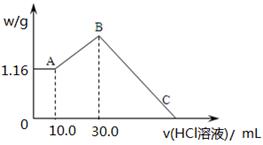
①A点的沉淀物的化学式为 。
②写出A点至B点发生反应的离子方程式: 。
③某溶液中溶有MgCl2和AlCl3两种溶质,若把两者分开,应选用的试剂为: 。
④原混合物中NaOH的质量是 g,C点(此时沉淀恰好完全溶解)HCl溶液的
体积为 mL。
实验室用18.4mol/L的浓硫酸来配制480mL 0.2mol/L的稀硫酸。
(1)所需玻璃仪器除了玻璃棒、烧杯外,还有 。
(2)所需量取浓硫酸的体积为 mL。
(3)下列操作对所配制的稀硫酸浓度有何影响?(用“偏高”“偏低”“无影响”填空)
A.用量筒量取浓硫酸时,洗涤量筒后将洗涤液转移到小烧杯中 。
B.定容时仰视刻度线 。