I、表中①~⑥为部分短周期元素的化合价及原子半径
| 元素性质[ |
元素编号 |
|||||
| ① |
② |
③ |
④ |
⑤ |
⑥ |
|
| 原子半径/nm |
0.102 |
0.110 |
0.074 |
0.075 |
0.071 |
0.099 |
| 最高化合价 |
+6 |
+5 |
|
+5 |
|
+7 |
| 最低化合价 |
-2 |
-3 |
-2 |
-3 |
-1 |
-1 |
II、B与C两元素可形成化合物CB2、CB3,二者均可用于制备化合物甲
III、A与B两元素可形成化合物AB、AB2,二者均可用于制备化合物乙。
A、B、C均为上表中的元素,甲、乙为中学常见强酸。
请回答下列问题
(1)写出B元素位于周期表中的位置__________________
(2)A元素气态氢化物的结构式为_____,写出上述元素形成的最稳定的氢化物的电子式____
(3)下列关于物质甲、乙的说法中正确的是__________(填字母)
a.二者的浓溶液在常温时均可用铁制容器贮存
b.二者的浓溶液在敞口容器中放置,质量都会变化
c.二者的浓溶液在常温时均与铜反应 d.二者的稀溶液均具有强氧化性
(4)请写出工业上由CB2制备CB3的化学方程式___________________________。写出工业生产强酸乙的过程中制备化合物AB的化学方程式______________
(每空2分共12分)在配制物质的量浓度溶液时,下列操作出现的后果是(填“偏低”“偏高”“无影响”):
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体________________
(2)配制氢氧化钠溶液时,未冷却至室温就转移入容量瓶并定容_____________
(3)配制氢氧化钠溶液时,未洗涤小烧杯和玻璃棒______________
(4)配制氢氧化钠溶液时,容量瓶内残留少量水_____________
(5)配制氢氧化钠溶液时,定容时俯视刻度线______________
(6)配制氢氧化钠溶液时,定容时发现液面超过刻度线,立即用吸管吸出少量水,使液面降至刻度线_______________
钢铁的生产与使用是人类文明和生活进步的一个重要标志。
(1)工业铝热法炼铁的主要化学反应方程式。
(2)炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。试回答:①铁锅的腐蚀主要是由腐蚀造成的。
②铁锅锈蚀的负极反应式为。
(3)通常使用钢铁是铁和__________的合金;当马口铁(表层镀锡)镀层被损坏后,这时被腐蚀速度比普通铁_______(填“快”或“慢”)。为防止轮船的船体在海水中腐蚀,一般在船身连接(填“锌块”或“铜块”)
Ⅰ保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐相处。
⑴pH< 的雨水称为酸雨;向煤中加入适量的,可以大大减少燃物产物中SO2的量。
⑵对汽车加装尾气催化净化装置,可以使其中的NO、CO相互反应转化成无毒的气体,其原理可以用化学方程式表示为。
⑶获得洁净安全的饮用水是每个人的正常需要。某农村地区为获得饮用水,在将地表水取回家后,常使用漂白粉或漂白精片进行杀菌消毒,其原理可用化学方程式表示为。
Ⅱ(1) (5分) 下列常用物质:
| A.碳酸镁 | B.阿斯匹林 | C.葡萄糖 | D.苯甲酸钠 E.柠檬黄(请用字母填空) |
具有解热镇痛疗效的是,可直接进入人体血液补充能量的是,可用作食品防腐剂的是,常用作食品着色剂的是,常用作治疗胃酸过多的抗酸剂的是。
(2)
①氢氧化铝,小苏打均可防治胃酸分泌过多,其发挥功效时的化学方程式
;。
②淀粉在抗酸药中作填充剂、粘合剂,淀粉在人体内酶的催化作用下发生水解反应,最终转化为(写分子式)。
③发育出现障碍,患营养缺乏症,这主要是由于摄入蛋白质不足引起的。蛋白质在人体内水解的最终产物是。
A、B、C、D、E五种物质都含同一种元素,C为一种淡黄色的固体化合物。它们按下图所示的关系相互转化,已知A为单质。分别写出有关反应的化学方程式。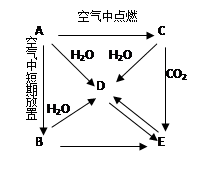
(1)用化学式来表示下列物质:
B:D:E:
(2)写出以下几步反应的化学方程式
A→D:
C→E:
D→E:
(10分)下列各组物质的分离或提纯,应选用下述方法的哪一种?(用编号填空)
| A.分液 | B.过滤 | C.萃取 | D.蒸馏 |
E、蒸发结晶 F、加热分解
① 除去Ca(OH)2溶液中悬浮的CaCO3 ;
② 从碘水中提取碘 ;
③ 用自来水制取蒸馏水 ;
④ 除去碳酸钠固体中少量的碳酸氢钠固体 ;
⑤ 分离植物油和水 ;