甲酸(HCOOH)是一种有刺激臭味的无色液体,有很强的腐蚀性。熔点8.4℃,沸点100.7℃,能与水、乙醇互溶,加热至160℃即分解成二氧化碳和氢气。
(1)实验室可用甲酸与浓硫酸共热制备一氧化碳:HCOOH浓硫酸========H2O+CO↑,实验的部分装置如下图所示。制备时先加热浓硫酸至80℃—90℃,再逐滴滴入甲酸。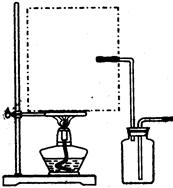
Ⅰ制备CO Ⅱ Ⅲ收集CO
①从下图挑选所需的仪器,画出Ⅰ中所缺的气体发生装置(添加必要的塞子、玻璃管、胶皮管,固定装置不用画),并标明容器中的试剂。
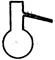


分液漏斗 长颈漏斗 蒸馏烧瓶 集气瓶 温度计
② 装置Ⅱ的作用是 。
(2)实验室可用甲酸制备甲酸铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸反应制得四水甲酸铜[Cu(HCOO)2·4H2O]晶体。相关的化学方程式是:
2CuSO4+4 NaHCO3= Cu(OH)2·CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2·CuCO3+4HCOOH+ 5H2O="2" Cu(HCOO)2·4H2O+ CO2↑
实验步骤如下:
Ⅰ、碱式碳酸铜的制备: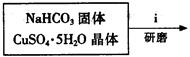
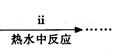
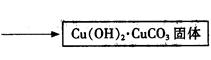
③步骤ⅰ是将一定量CuSO4·5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是 。
④步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃—80℃,如果看到 (填写实验现象),说明温度过高。
Ⅱ、甲酸铜的制备:
将Cu(OH)2·CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的1/3时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2—3次,晾干,得到产品。
⑤“趁热过滤”中,必须“趁热”的原因是 。
⑥用乙醇洗涤晶体的目的是 。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)如图1是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(图中涉及物质均为气态),请写出NO2和CO反应的热化学方程式 。
(2)在0.5L的密闭容器中,充入一定量的氮气和氢气进行反应,三种气体的物质的量随时间的变化曲线如图2所示。则Y是 ,2min内N2的反应速率υ(N2)= 。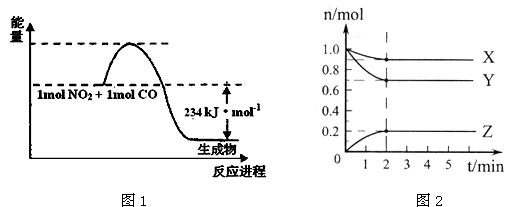
(3)硝酸工业在国民经济、国防工业和航天事业中占有重要地位。随着化学纤维、近代有机合成、火箭、导弹等工业的迅速发展,需要使用大量的硝酸。
①工业生产中用铂系金属作为催化剂,用氨氧化法制取硝酸。第一步反应为氨在催化剂作用下与氧气发生反应生成NO,写出反应化学方程式 。
②铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3 →Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)。反应中还原产物是 ,0.6mol Cu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则得到标准状况下气体体积为 L。
水是生命之源,也是化学反应中的主角。请回答下列问题:
Ⅰ、氢气燃烧生成液态水热化学方程式是2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ/mol。
(1)生成物能量总和(填“大于”、“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 572 kJ(填“>”、“<”或“=”)。
(3)氢气热值为 。
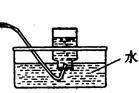
Ⅱ、氢气和氧气反应生成水,将化学能转化为电能,其构造如图所示:a、b两个电极均由多孔的碳块组成。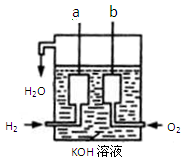
(1)a电极反应式是 。
(2)b电极反应式是 。
Ⅲ、如图表示一个电解池。X、Y都是惰性电极,电解液a是饱和食盐水,同时在两边各滴入几滴酚酞试液。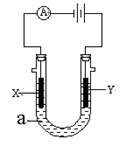
(1)X极上的电极反应式为 ,在X极附近观察到的现象是 。
(2)Y极上的电极反应式为 ,检验该电极反应产物的方法是 。
按要求填空:
(1)原子种类由 决定;第三周期半径最小的元素形成的简单离子的离子结构示意图是 ;
(2)以黄铁矿为原料生产硫酸的工艺流程如下图所示,设备B的名称为 ;设备A中发生反应的化学方程式 ;
(3)如下图是实验室中常用于测定盐酸和氢氧化钠溶液反应热的装置,此装置名称叫 ;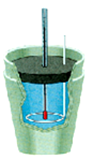

(4)0.5 mol CH3OH(l)完全燃烧生成二氧化碳气体和液态水时放出热量为363.2 kJ,写出表示CH3OH(l)燃烧热的热化学方程式 。
实验室用加热固体氯化铵和氢氧化钙的混合物制取氨,反应的化学方程式为: 。
所制得气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出适当选择,并将编号字母填入表中的空格处。
(1)装置: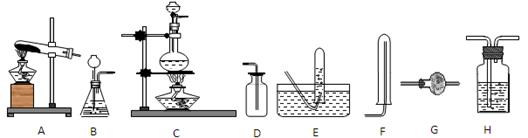
(2)试剂:
a.NaOH溶液
b.澄清石灰水
c.浓硫酸
d.饱和NaHCO3溶液
e.碱石灰
f.品红溶液
g.湿润的红色石蕊试纸
| 制取气体 |
杂质气体 |
制取气体的发生装置 |
除去杂质气体的净化装置 |
收集装置 |
净化装置内 所用试剂 |
检验制得气体所用试剂 |
| NH3 |
H2O(g) |
以下为五种有机物的有关信息,根据表中信息回答问题。
| A |
B |
D |
E |
F |
| ①由C、H、O 三种元素组成的液体; ②与水任意比例互溶。 |
其产量用来衡量一个国家的石油化工水平。 |
比例模型为: |
①可用于除水垢 ②在低于16.6℃时,凝固成冰一样的晶体。 |
由5个原子组成的10个电子的共价分子。 |
(1)A的官能团名称为________,对A的描述正确的是_________。
①有毒
②无色无味
③密度比水小
④与酸性高锰酸钾溶液反应使其褪色
⑤在海带提碘实验中作萃取剂从碘水中提取碘单质
⑥在热Cu丝作用下生成相对分子质量比它小2的有机物
A.①③⑤B.②③④C.③④⑥D.④⑤⑥
(2)B的电子式为 ,把一定体积的B、F混合气体通过溴水,有
反应(填反应类型)发生,当溴水的质量增加2.8g时,生成物的质量为 g。(能用到的相对原子质量:H 1;C 12;O 16;Br 80)
(3)工业上,D来源于煤 (填操作名称)后的液态产物煤焦油。D在浓硫酸、
50~60℃水浴中与浓硝酸发生取代反应,生成的有机物的结构简式为 。
(4)写出用18O标记的A与不含18O的E在一定条件下发生反应的化学方程式(注明反应条件)。 。
下图为实验室进行该反应时的装置图,其中有 处错误。