实验室用加热固体氯化铵和氢氧化钙的混合物制取氨,反应的化学方程式为: 。
所制得气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出适当选择,并将编号字母填入表中的空格处。
(1)装置:
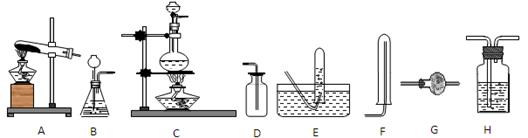
(2)试剂:
a.NaOH溶液
b.澄清石灰水
c.浓硫酸
d.饱和NaHCO3溶液
e.碱石灰
f.品红溶液
g.湿润的红色石蕊试纸
| 制取气体 |
杂质气体 |
制取气体的发生装置 |
除去杂质气体的净化装置 |
收集装置 |
净化装置内 所用试剂 |
检验制得气体所用试剂 |
| NH3 |
H2O(g) |
|
|
|
|
|
某化学实验小组用如图所示的装置制取乙酸乙酯,并检验乙酸乙酯中是否含有乙酸杂质(铁架台、夹子等支撑仪器省略)。已知乙酸乙酯的沸点为77.1℃,乙醇沸点为78.4℃,乙酸的沸点为118℃。请根据要求填空:
⑴写出实验室用冰醋酸和无水乙醇制乙酸乙酯的化学方程式:
__________________。
⑵为使反应物充分反应,以下措施中正确的是(填写对应序号)。
①先小火温热,再慢慢升温至微沸状态②先大火加热至沸腾状态,并持续加热保持沸腾状态③使用稀硫酸作催化剂④作用浓硫酸作催化剂
⑶如果单孔塞上的导管短一些,对乙酸乙酯的收集有何影响,简述原因。
答:。
⑷A同学将收集到的乙酸乙酯滴入含有少量酚酞的NaOH溶液中并在水浴中温热,发现溶液的红色逐渐变浅,由此得出乙酸乙酯中含有乙酸的结论,你认为这一结论正确吗?为什么?
答:。
⑸B同学将收集到的乙酸乙酯滴入饱和NaHCO3溶液中,观察到有少量气泡产生,可得出的结论是,该过程中发生反应的化学方程式是。
⑹C同学将收集到的乙酸乙酯缓缓滴入饱和Na2CO3溶液中,无气泡产生,于是得出该乙酸乙酯中不含乙酸的结论。请你运用所学知识,评价该同学的结论是否正确。
我的评价是:。
CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:、。
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中可能存在的杂质是,除去这种杂质的实验操作称为。
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4
称取0.1000 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则0.1000 g该试样中含CuSO4·5H2O g。
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用。
在滴定中,准确读数应该是滴定管上蓝线所对应的刻度。
(5)如果采用重量法测定CuSO4·5H2O的含量,完成下列步骤:
①②加水溶解③加氯化钡溶液,沉淀④过滤(其余步骤省略)
在过滤前,需要检验是否沉淀完全,其操作是
(6)如果1.040 g提纯后的试样中含CuSO4·5H2O的准确值为1.015 g,而实验测定结果是l.000 g 测定的相对误差为。
实验室制取少量溴乙烷的装置如右图所示。根据题意完成下列填空:
(1)圆底烧瓶中加入的反应物是溴化钠、 和1:1的硫酸。配制体积比1:1的硫酸所用的定量仪器为 (选填编号)。
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)写出加热时烧瓶中发生的主要反应的化学方程式 。
(3)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是 。
试管A中的物质分为三层(如图所示),产物在第 层。
(4)试管A中除了产物和水之外,还可能存在 、 (写出化学式)。
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是 (选填编号)。
a.蒸馏b.氢氧化钠溶液洗涤
c.用四氯化碳萃取d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是 。
(6)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是: 。
已知硝酸锏溶液颜色为蓝色.某学校化学课外小组同学们在做铜与浓硝酸、稀硝酸反应的实验中,发现铜和浓硝酸反应后溶液为绿色旦有红棕色气体产生,而铜和稀硝酸反应后溶液为蓝色,产生无色气体.为弄清反应后溶液颜色出现差异的原因,他们进行了实验探究.
【实验】在两支试管中各放入一小块等质量的铜片,分别加人等体积的浓HN03(14 mol•
L-1)和稀HN03(4mol . L-1 ), 立即用蘸有NaOH的棉花封住试管口。充分反应后铜均无剩余。
(1) Cu与浓HNO3反应的离子方程式______________________________
(2) 用蘸有NaOH的棉花封住试管口的原因________________
【提出假设】假设一、因为铜离子浓度大造成的。
假设二、溶液呈绿色是因为铜与浓硝酸反应时产生的二氧化氮溶于过量浓硝酸,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色。
【设计实验方案,验证假设】
(3)上述实验________(“能”或“不能”)证明假设一不成立,原因________________
(4) 甲同学设计实验验证假设二,请帮他完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)
【分析推理】
(5)铜和稀硝酸反应后溶液为蓝色的原理________________
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验。
【实验1】铜与浓硫酸反应,实验装置如图所示。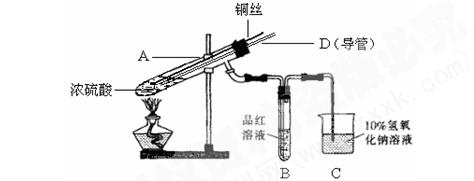
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为____。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应,生成Cu2+和铜单质。在氧气流中煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于盐酸。在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图的实验:
(4)②中检验滤渣是否洗涤干净的实验方法是。
(5)③中在煅烧过程中一定发生的反应的化学方程式为。
(6)下列对于固体甲的成分的判断中,正确的是(填字母选项)。
| A.固体甲中,CuS和Cu2S不能同时存在 |
| B.固体甲中,CuO和Cu2O至少有一种 |
| C.固体甲中若没有Cu2O,则一定有Cu2S |
| D.固体甲中若存在Cu2O,也可能有Cu2S |