(共10分) W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。由此可知:
(1)写出元素名称:W_________,X________,Y________,Z_________;Z在元素周期表中的位置_______ __。
(2)Y2Z的电子式为_______ __;W2X2的结构式__________。
(3)两种均含四种元素的化合物相互反应放出气体的化学方程式是 _______
甲、乙、丙三种物质之间有如下图所示的转化关系,其中甲物质为氧化物:
(1)若甲是不溶于水的白色固体,但既能溶于硫酸又能溶于氢氧化钠溶液, 写出下列转化的方程式:
乙 丙的离子方程式______________________; 丙
丙的离子方程式______________________; 丙 甲的化学方程式____________________。
甲的化学方程式____________________。
(2)若向乙溶液中加入KSCN溶液,混合溶液呈红色,则甲物质是________(填化学式)。 甲 乙的离子方程式是_____________________________。
乙的离子方程式是_____________________________。
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。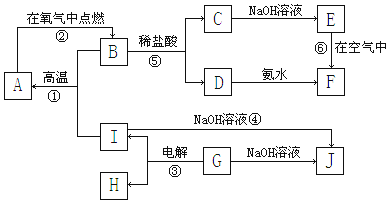
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置第周期、第族;
(2)写出反应①的化学方程式;
(3)写出反应④的离子方程式;
(4)写出反应③的电极方程式:
阳极:阴极:
(5)从能量变化的角度看,①②③反应中属于△H<0的反应是。(填序号)
豆类作物中含有的天然蛋白质在酶的作用下,水解生成A、B两种有机物。其中A的化学式为C4H7O4N,B的化学式为C6H14O2N2;已知A、B的分子结构中均不含甲基,且链端都有官能团。
(1)A的结构简式为:_______________________________________________________;
B的结构简式为:_________________________________________________________。
(2)题中酶的作用是_______________________________________________________;
影响其作用的主要因素有_________________________________________________。
合理膳食,保持营养均衡,合理使用药物是青少年学生健康成长的重要保证。
①维生素C能增强人体对疾病的抵抗能力,促进人体生长发育。在氯化铁溶液中加入维生素C溶液后,溶液由黄色转变为浅绿色,说明维生素C具有________性。
②________(填字母)具有止咳平喘作用,可用于治疗支气管哮喘、鼻粘膜充血引起的鼻塞等。
a.麻黄碱 b.阿司匹林 c.抗酸药 d.青霉素
③人们每天摄取的热能中大约有75%来自糖类,淀粉是一种重要的多糖,它在人体内水解的最终产物是________(填分子式)。碘元素是人体必需的微量元素之一,有“智力元素”之称,目前,我国通过在食盐中加入________(填化学式)从而达到补碘的效果。生物制药中往往涉及到活性蛋白质的提纯,可以采用的一种方法是________(填“过滤”、“高温蒸馏”或“盐析”)。淀粉、纤维素、油脂、蛋白质中不属于天然高分子的是________________。
下列叙述正确的是______。
①乙烯使酸性高锰酸钾溶液褪色,发生加成反应;②苯在一定条件下,既能发生取代反应,又能发生加成反应;③乙烯在常温常压下可以与氢气、HCl发生加成反应;④CH2===CH—CH3+Br2 CH2Br—CH===CH2+HBr属于加成反应;⑤苯使溴水褪色发生加成反应;⑥苯与液溴在三氯化铁作催化剂的条件下发生加成反应;⑦乙烷、乙醇、乙酸、苯、纤维素、油脂、蛋白质均能发生取代反应;⑧乙烯通入溴水中发生取代反应;⑨乙醇可以被氧化为乙酸,二者都能发生酯化反应。
CH2Br—CH===CH2+HBr属于加成反应;⑤苯使溴水褪色发生加成反应;⑥苯与液溴在三氯化铁作催化剂的条件下发生加成反应;⑦乙烷、乙醇、乙酸、苯、纤维素、油脂、蛋白质均能发生取代反应;⑧乙烯通入溴水中发生取代反应;⑨乙醇可以被氧化为乙酸,二者都能发生酯化反应。