(10分)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W的气态氢化物化学式为 ,它的沸点比PH3的沸点 ,
(填“高”或“低”)W的气态氢化物稳定性比H2O(g)____ ____(填“强”或“弱”)。
(2)Y的基态原子核外电子排布式是________ ______,Y的第一电离能比X的______ __(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
。
(4)已知下列数据:
Fe(s)+O2(g)===FeO(s) ΔH=-272.0 kJ·mol-1
2X(s)+O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
X的单质和FeO反应的热化学方程式是___________ ___________________。
硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡,Sn相对原子质量为119
回答下列问题:
(1)锡原子的核电荷数为50,锡元素在周期表中的位置是。
(2)操作Ⅰ是。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因。
(4)加入Sn粉的作用有两个:①调节溶液pH②。
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是。
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是。
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl===SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl ===6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.226 g锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0ml。锡粉中锡的质量分数是。
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,溶液中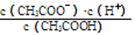 (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式。
(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式。
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为。
(3)常温下向20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下: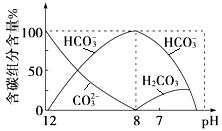
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有、,溶液中含量最多的三种微粒的物质的量浓度的大小关系为;
(12分)许多尾气中含有NOx、S02等造成空气污染的气体。根据要求回答下列问题:
(1)已知:N02(g)+CO(g)≒C02(g)+NO(g)。
①密闭容器中发生该反应时,c(C02)随温度(T)变化曲线如图所示。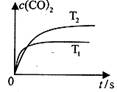
据此判断,升高温度,该反应的平衡常数(选填“增大”、“减小”、“不变”)。
②NO对臭氧层破坏的主要过程为: Ⅱ.NO+03→N02+02 Ⅲ.N02+O→NO+02
Ⅱ.NO+03→N02+02 Ⅲ.N02+O→NO+02
该过程中NO的作用为。
(2)将C02和H2合成二甲醚(cH30CH3)已取得了较大的进展,其化学反应为:
2C02(g)+6H2(g)≒CH30CH3(g)+3H20(g)
①1 mol二甲醚气体完全燃烧生成两种气态氧化物,放出能量q kJ,请写出该反应的热化学方程式;
②二甲醚可以作为燃料电池的燃料,若用硫酸做电池中的电解质溶液,请写出该燃料电池工作时正极电极反应式。
(3)室温条件下,用0.10 mol·L-1盐酸分别滴定20.00 mL浓度均为0.10 mo1.L-1的NaOH溶液和氨水,下图是滴定其中一种溶液时,所得混合液的pH与加入盐酸体积的关系曲线图。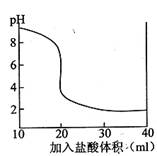
①该曲线表示滴定(填“NaOH”或“氨水”)的过程;
②当向20.00 mLNaOH溶液中加入V mL盐酸时,所得混合溶液pH=12,则v=。(保留2位小数)。
(8分)A、B、C、D均为中学化学常见的、含同种元素的纯净物,A为单质,它们间有如图反应关系。根据要求回答问题: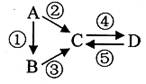
(1)若A是大气中含量最多的气体,D为红棕色气体。则D转化成C的反应化学方程式为。
(2)若A、B、C分别为C(s)、CO(g)和CO2(g),且通过与O2(g)反应实现图示的转化。在同温同压且消耗含碳物质均为l mol时,反应①、②、③的焓变依次为△H1、△H2、△H3,则它们之间的关系为(用含△H1、△H2、△H33的代数式表示)。
(3)若C为一元强碱且阴、阳离子所含的电子数相同,D为海水中富含的物质,请写出工业上用D制备A的化学方程式。
(4)往两份C的溶液中分别滴入硝酸酸化的硝酸银、KSCN溶液,将观察到白色沉淀、显血红色,且反应④为C与A的反应。请简述实验室保存D溶液的方法。
(10分)X、Y、Z、R、W为五种原子序数依次增大的短周期元素。已知:
①X元素的原子半径是所有原子中最小的;
②Y元素的原子最外层电子数是最内层电子数的2倍。
③Y与R可以形成YR与YR2两种化合物,其中一种是造成温室效应的物质之一。
④W与R能形成原子个数之比为2:1和l:1的离子化合物甲和乙。
根据要求回答问题:
(1)R在周期表中的位置是。
(2)Y、R、W三种元素的原子半径由大到小顺序为(用元素符号表示)。
(3)X2R与乙反应的化学方程式是。
(4)元素Y、R、W形成的化合物的水溶液常用作清洗厨房的油污,其原理是(用离子方程式表示)。0.1 mol·L-1该溶液中,各种阴离子的浓度由大到小关系为。