实验室利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4 + 6HCHO = 3H++ 6H2O + (CH2)6N4H+
+ 6HCHO = 3H++ 6H2O + (CH2)6N4H+
然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行如下实验:
[滴定时,1 mol (CH2)6N4H+与1 mol H+相当]
步骤Ⅰ:称取样品1.500 g
步骤Ⅱ:将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀
步骤Ⅲ:移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1-2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次
步骤Ⅳ:实验数据记录
<若NaOH标准溶液的浓度为0.1010 mol/L>
| 滴定次数 |
待测液的体积(mL) |
标准溶液的体积 |
|
| 滴定前刻度(mL) |
滴定后刻度(mL) |
||
| 1 |
25.00 |
1.02 |
21.03 |
| 2 |
25.00 |
2.00 |
21.99 |
| 3 |
25.00 |
0.20 |
20.20 |
根据上述实验步骤填空:
(1)滴定操作时,眼睛应观察
(2)滴定终点的判断方法是
(3)锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)
(4)碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏大”、“偏小”或“无影响”)
(5)配制样品溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、滴定管外,还有 (填仪器名称)
该样品中氮的质量分数为
实验室里需要纯净的氯化钠溶液,但只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如下方案: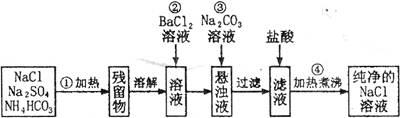
请根据操作流程回答下列问题:
(1)操作 ① 在加热时可选择仪器盛装混合物。
(2)操作 ② 是否可改为加硝酸钡溶液?为什么?。
(3)进行操作 ② 后,如何判断SO42-已沉淀完全?。
(4)操作 ③ 的目的是。
(5)操作 ④ 的目的是。
(18分,每小题2分)用质量分数为98%,密度为1.84g/cm3的浓硫酸来配置500ml,0.2mol/L的稀硫酸。可供选择①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒⑥容量瓶⑦托盘天平⑧药匙.请回答下列问题:
(1)上述仪器中,在配制稀硫酸时用不到的有(填代号).
(2)经计算,需浓硫酸的体积为mL(保留一位小数);。
(3)将浓硫酸加适量蒸馏水稀释后,冷却片刻,随后全部转移到mL的容量瓶中,转移时应用玻璃棒.转移完毕,用少量蒸馏水洗涤2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀.然后缓缓地把蒸馏水直接注入容量瓶直到液面接近瓶颈刻度cm处,改用滴加蒸馏水,使.塞上瓶塞、摇匀后,把溶液倒入试剂瓶、贴上标签.
(4)定容时,俯视刻度线,所配溶液的物质的量浓度将(选填“偏高”、“偏低”或“不变”)
(1)用50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题: 
①烧杯间填满碎泡沫塑料的作用是。
②若大烧杯上改为盖薄铁板,求得的反应热数值:(填“偏大”、“偏小”或“无影响”)
③若通过测定计算产生的热量为1.42kJ,请写该反应的热化学方程式:。
(2)①已知:CH4(g)+H2O(g)===CO(g)+3H2(g)ΔH=+206.2 kJ·mol-1
CH4(g)+CO2(g)===2CO(g)+2H2(g)ΔH=+247.4 kJ·mol-1
则以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:。
②由气态基态原子形成1 mol化学键释放的最低能量叫键能。已知表中所列键能数据, 则N2(g)+3H2(g) 2NH3(g) ΔH=kJ·mol-1。
2NH3(g) ΔH=kJ·mol-1。
| 化学键 |
H—H |
N—H |
N≡N |
| 键能kJ·mol-1 |
436 |
391 |
945 |
③一定条件下,在水溶液均为1 mol以下离子 Cl-、ClO-、ClO2-、ClO3-、ClO4-的能量(kJ)相对大小如下图所示,则3ClO-(aq)===ClO (aq)+2Cl-(aq)的ΔH=kJ·mol-1。
(aq)+2Cl-(aq)的ΔH=kJ·mol-1。
某化学兴趣小组想探究某一温度下氯化钠饱和溶液的酸碱度。探究过程如下:
【猜想或假设】溶液的pH可能为:①pH<7,②,③。
【设计和实验】要测定该溶液的酸碱度,除有正确的操作步骤外,其中不能采用下列物质中的(填序号)来进行实验。
①pH试纸②紫色石蕊试液③酚酞试液
组内同学进行了如下实验:
甲同学:取pH试纸放在玻璃片上,用玻璃棒蘸取氯化钠溶液沾在pH试纸上,把试纸显示的颜色与标准比色卡比较,测得pH=7。
乙同学:取pH试纸放在玻璃片上,先用蒸馏水将pH试纸润湿,然后用玻璃棒蘸取氯化钠溶液沾在pH试纸上,把试纸显示的颜色与标准比色卡比较,测得pH=7。
丙同学:将pH试纸直接浸入氯化钠溶液中,把试纸显示的颜色与标准比色卡比较,测得pH=7。
【评价与反思】三位同学中操作正确的是同学。
指出其于同学的操作错误:
同学:;
同学:;
【结论与分析】丙同学得出:“凡是盐溶液的pH都等于7”,你认为该同学结论
(填“正确”或“不正确”)。
如不正确,请举一例说明(如正确,该处不填)。
(本题包括2个小题,共18分)
19.某淡黄色的颗粒状固体,其化学性质比较活泼,在通常状况下能跟许多物质发生化学反应。例如:它与CO2反应时,只生成了Na2CO3和O2,它与稀盐酸反应时,只生成了NaCl、H2O和O2。上课时,老师做了如下实验:
a.取少量的淡黄色的颗粒状固体投入到盛有少量水的试管中,可观察到产生了一种无色无味的气体;
b.再向试管中滴加几滴酚酞试液,可观察到烧杯中溶液变红。
根据实验现象,回答下列问题:
(1)淡黄色的颗粒状固体中一定含有元素。你做出这个判断的理由是。
(2)实验a中产生的气体,可用法收集。
(3)同学们对实验a中产生的气体的组成看法不一,提出了以下几种假设:
①该气体是CO;②该气体是H2。
请你推测该气体还可能是(写化学式)。
(4)设计一个实验,证明你在(3)中的推测(写出简要操作步骤,反应现象和结论)。
| 操作步骤 |
|
| 反应现象 |
|
| 结论 |