(包括2小题,满分共10分)
Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是_______________________(可以多选)
A.用pH试纸测定Na2CO3溶液的pH
B.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
C.实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
D.配制一定物质的量浓度的氯化钠溶液
E.取某溶液做焰色反应实验,说明该溶液中含有钠元素
F.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
G.促使过饱和的硝酸钾溶液析出晶体
H.用倾析法进行分离、洗涤颗粒较大的沉淀
Ⅱ.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
⑴写出电解时发生反应的化学方程式: ;
⑵除去ClO2中的NH3可选用的试剂是 ;(填序号)
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水
⑶测定ClO2(如右图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I- +S4O62-),共用去VmL硫代硫酸钠溶液。①装置中玻璃液封管的作用是 ;
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式 ;
③测得ClO2的质量m(ClO2)= 。(用含c、V的代数式表示)
下图是中学常见物质间的转化关系。已知:
a.A为淡黄色固体,B为导致“温室效应”的主要物质;
b.E为常见金属,J为红褐色沉淀;
c.G在实验室中常用于检验B的存在;
d.L是一种重要的工业原料,常用于制造炸药,浓溶液若保存不当常呈黄色。
回答下列问题:
(1)A的电子式为;B分子属于分子(极性、非极性);
(2)反应①的化学方程式为,
反应②的离子方程式为,
(3)若参加反应的A的质量为39g,则消耗CO2的体积(标况下)为L。
(4)检验K中阳离子常用的方法是。
(5)L浓溶液的保存方法是。
在80 ℃时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4(g) 2NO2(g)ΔH >0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g)ΔH >0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间/s n/mol |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算20~40 s内用N2O4表示的平均反应速率为____________mol· L-1·s-1。
(2)计算在80 ℃时该反应的平衡常数K=___________。
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色___________(填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有___________(填序号)。
| A.增大N2O4的起始浓度 | B.向混合气体中通入NO |
| C.使用高效催化剂 | D.升高温度 |
(5)如图是80 ℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60 ℃时N2O4物质的量的变化曲线。
(16分)
(1)1840年前后,瑞士科学家盖斯(Hess)指出,一个化学反应的热效应,仅与反应物的最初状态及生成物的最终状态有关,而与中间步骤无关,这就是著名的“盖斯定理”。现已知,在101 kPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.3 kJ·mol-1、285.8 kJ·mol-1和393.5 kJ·mol-1,则反应C(s)+2H2(g)= CH4(g)的反应热ΔH=__________,根据以上信息,你认为“盖斯定理”在我们确定一些化学反应的反应热时有何重要意义?__________。
(2)已知:2H2(g)+O2(g)====2H2O(g) ΔH1
2H2(g)+O2(g) ====2H2O(l)ΔH2
2CO(g)+O2(g)====2CO2(g)ΔH3
①写出液态水转化为气态水的热化学方程式:___________________________________。
②CO和H2分别燃烧生成CO2(g)和H2O(g),欲得到相同热量,所需CO和H2的体积比是__________。
(14分)某化学反应2A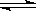 B+D在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表: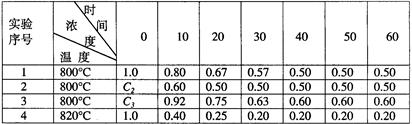
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率V(B)为mol/(L·min)。
(2)在实验2,A的初始浓度C2=mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3V1(填>、=、<),且C31.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是反应(选填吸热、放热)。
(14分)反应3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g),在一可变的容积的密闭容器中进行,试回答:
①增加Fe的量,其正反应速率的变化是(填增大、不变、减小,以下相同)
②将容器的体积缩小一半,其正反应速率,逆反应速率。
③保持体积不变,充入N2使体系压强增大,其正反应速率,逆反应速率。
④保持压强不变,充入N2使容器的体积增大,其正反应速率,逆反应速率。