2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。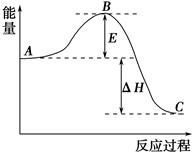
请回答下列问题:
(1)图中A、C分别表示________、________,E的大小对该反应的反应热有无影响?________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是____________________________;
(2)图中ΔH=________kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:_____________________________________________;
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 mol SO3(g)的ΔH(要求计算过程)。(已知燃烧热是指25 ℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量)
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H 1=+489.0 kJ·mol-1
C(石墨)+CO2(g)=2CO(g)△H 2=+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H
CH3OH(g)+H2O(g)△H
①该反应的平衡常数表达式为K=。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图所示,则该反应的ΔH0(填“>”、“<”或“=”)。
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠKⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为。当氨碳比 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为
。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为。
工业上用白云石制备高纯氧化镁的工艺流程如下:
已知白云石的主要成分可表示为:
CaO 32.50%;MgO 20.58%;Fe2O3 2.18%;SiO2 0.96%;其他 43.78%
(1)为了提高白云石的煅烧效果,可以采取的措施是。
若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要。
| A.蒸发皿 | B.坩埚 | C.泥三角 | D.石棉网 |
(2)加入H2SO4控制pH时,终点pH对产品的影响如图所示,pH过高会导致镁浸率降低,其原因为,pH过低对产品影响是。
(3)从溶液中获得CaSO4·2H2O的操作是蒸发浓缩、、过滤、洗涤、干燥。
(4)写出沉淀反应中的离子方程式:。检验沉淀是否洗净的方法是:。
(5)沉淀反应过程中,温度对产品的纯度也有一定的影响。如图为反应温度对氧化镁纯度的影响。最终确定本反应的适宜温度为。
钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中。钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为;步骤③中反应的离子方程式为:。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将(填“偏高”、或“偏低”或“不变”)。
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00 mol·L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程。
卡巴拉丁是一种重要的药物,用于治疗轻、中度阿尔茨海默型痴呆症。以下是卡巴拉丁的合成路线:
请回答下列问题:
(1)A分子中含氧官能团的名称为:、。
(2)由B生成C的反应类型为:。D的结构简式为:。
(3)实现E→卡巴拉丁的转化中,加入化合物X(C4H8NOCl)的结构简式为。
(4)写出符合下列条件的A的一种同分异构体的结构简式:。
①能发生银镜反应;
②能水解且产物之一与氯化铁溶液发生显色反应;
③含有四种不同化学环境的氢。
(5)写出由氯甲基苯( )和丙酮(
)和丙酮( )制备化合物
)制备化合物 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
向盛有KI溶液的试管中加入少许CC14后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CC14层会逐渐变浅,最后变成无色。完成下列填空:
(1)上述过程CCl4层在试管中位于(填上、下)层,分离CC14层和水层的操作名称是____,使用的玻璃仪器是。
(2)写出并配平CC14层由紫色变成无色的化学反应方程式(如果系数是l不用填写);
++→HIO3+
(3)把KI换成KBr。则CC14层变为色,该反应的离子方程式为。继续滴加氯水,CCl4层的颜色没有变化。Cl2、 HIO3、HBrO3氧化性由强到弱的顺序是。