砷为第4周期第ⅤA族元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是( )
| A.AsH3的稳定性比PH3强 | B.可以存在-3、+3、+5等多种化合价 |
| C.As2O5对应水化物的酸性比H3PO4弱 | D.砷在通常情况下是固体 |
如下图所示容器中盛有海水,锌在其中被腐蚀速率最慢的是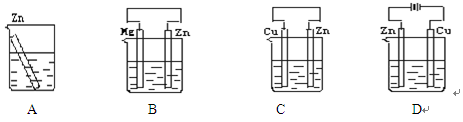
实验室中,下列除去括号内杂质的有关操作正确的是
| A.苯(硝基苯):加少量水振荡,待分层后分液 |
| B.乙醇(水):加新制生石灰,蒸馏 |
| C.CO2(HCl、水蒸气):通过盛有碱石灰的干燥管 |
| D.乙烷(乙烯):催化加氢 |
在2A(g)+B(g)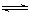 3C(g)+4D(g)反应中,表示该反应速率最快的是
3C(g)+4D(g)反应中,表示该反应速率最快的是
A.v(A)=0.5 mol/(L·s) B.v(B)=0.3 mol/(L·s)
C.v(C)=0.8 mol/(L·s) D.v(D)=1 mol/(L·s)
脑白金又名褪黑素,据报道它具有提高免疫力、促进睡眠等功效,其结构简式为: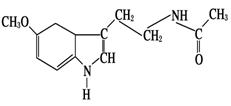
下列关于脑白金说法不正确的是
| A.能发生加成反应 |
| B.属于芳香族化合物 |
| C.分子式为C13H18N2O2 |
| D.能使酸性高锰酸钾溶液褪色 |
下列叙述错误的是
| A.乙烯和苯都能使溴水褪色,褪色的原因相同 |
| B.淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| C.煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |
| D.乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中少量乙酸可用饱和Na2CO3溶液除去 |