下列说法正确的是( )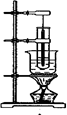

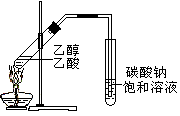
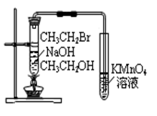
图1 图2 图3 图4
| A.图1为实验室制备硝基苯的装置 |
| B.图2中振荡后下层为无色 |
| C.制备乙酸乙酯:用右图所示的实验装置 |
| D.图4装置可以达到验证溴乙烷发生消去反应生成烯烃的目的 |
下列叙述正确的是
| A.当溶液中c(H+)=c(OH-)>10-7 mol/L时,其pH<7,溶液呈现酸性 |
| B.室温下,pH=3的盐酸和pH=11的氨水等体积混合后,溶液中离子浓度关系是: c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| C.Na2CO3溶液中存在c(OH-)= c(HCO3-) +2 c(H2CO3) + c(H+) |
| D.0.1mol/LNaHCO3中c(Na+)= c(HCO3-) + c(H2CO3) = 0.1mol/L |
在平衡体系Ca(OH)2(s) 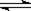 Ca2+(aq)+2OH-(aq)中,能使c(Ca2+)减小,而使pH增大的是
Ca2+(aq)+2OH-(aq)中,能使c(Ca2+)减小,而使pH增大的是
| A.加入少量MgCl2固体 | B.加入少量HCl溶液 |
| C.加入少量KCl固体 | D.加入少量Ba(OH)2固体 |
在恒温时,一固定容积的容器内发生如下反应:2NO2(g) 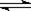 N2O4(g) 达平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后, NO2的体积分数
N2O4(g) 达平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后, NO2的体积分数
| A.不变 | B.增大 | C.减小 | D.无法判断 |
常温下,几种难溶电解质的溶度积和弱酸的电离常数如下表所示:
| CaSO4 |
CaCO3 |
MgCO3 |
Mg(OH)2 |
CuS |
BaSO4 |
H2S |
H2CO3 |
|
| Ksp或Ka |
9.1× 10-6 |
2.8×10-9 |
6.8× 10-6 |
1.8× 10-11 |
6.3× 10-36 |
1.1× 10-10 |
K1=1.3×10-7 K2=7.1×10-15 |
K1=4.4×10-7 K2=4.7× 10-11 |
则下列说法不正确的是
A.相同温度、相同浓度的钠盐溶液的pH:Na2S>Na2CO3>NaHS>NaCl>NaHSO4
B.在NaHS溶液中滴加硫酸铜溶液,生成黑色沉淀:HS-+Cu2+=CuS↓+H+
C.除去锅炉中水垢时,通常先加入足量硫酸钠溶液,将碳酸钙转化成硫酸钙,然后再用酸液处理
D.在Mg(HCO3)2溶液中滴加足量澄清石灰水发生反应的离子方程式为:
Mg2++2HCO +2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
关于体积相同,pH=3的盐酸和醋酸,下列叙述正确的是
| A.水的电离程度前者大于后者 | B.中和两者需要的NaOH的物质的量相同 |
| C.混合后pH不变 | D.稀释相同倍数,醋酸的pH大 |