有关X、Y、Z、W四种金属进行如下实验:
| ① |
将X和Y用导线连接,浸入电解质溶液中,Y不易腐蚀 |
| ② |
将片状的X、W分别投入等浓度盐酸中都有气体产生,W比X反应剧烈 |
| ③ |
用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出单质Z |
根据以上事实,下列判断或推测错误的是
A.Z的阳离子氧化性最强
B.W的还原性强于Y的还原性
C.Z放入CuSO4溶液中一定有Cu析出
D.用X、Z和稀硫酸可构成原电池,且X做负极
已知某温度下,反应 SO2(g)+NO2(g)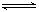 SO3(g)+NO(g)的平衡常数K=0.24,下列说法正确的是
SO3(g)+NO(g)的平衡常数K=0.24,下列说法正确的是
A.该温度下反应2SO2(g)+2NO2(g)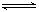 2SO3(g)+2NO(g) 的平衡常数为0.48 2SO3(g)+2NO(g) 的平衡常数为0.48 |
| B.若该反应ΔH <0,则升高温度化学平衡常数K减小 |
| C.若升高温度,逆反应速率减小 |
| D.改变条件使平衡正向移动,则平衡时n(NO2)/n(NO)一定比原平衡小 |
常温下,pH = 12的氢氧化钠和pH = 4的醋酸等体积混合后恰好中和,忽略混合后溶液体积的变化,下列说法中正确的是
| A.混合前的醋酸约1%发生电离 | B.混合后的溶液中c(Na+)=c(CH3COO—) |
| C.氢氧化钠和醋酸的浓度不相等 | D.混合后的溶液呈中性 |
一定条件下,向某密闭容器中加入一定量的N2和H2发生可逆反应N2(g)+3H2(g)  2NH3(g) ΔH = -92.2kJ•mol—1,测得0到10秒内,c(H2)减小了0.75mol•L—1,下列说法正确的是
2NH3(g) ΔH = -92.2kJ•mol—1,测得0到10秒内,c(H2)减小了0.75mol•L—1,下列说法正确的是
| A.10到15秒内c(NH3) 增加量等于0.25mol •L—1 |
| B.10秒内氨气的平均反应速率为0.025mol•L—1·s—1 |
| C.达平衡后,分离出少量NH3,v正增大 |
| D.该反应的逆反应的活化能不小于92.2kJ•mol—1 |
已知反应:①101 kPa时,2C(s)+O2(g)===2CO(g);ΔH=-221 kJ·mol-1;
②稀溶液中,H+(aq)+OH-(aq)===H2O(l);ΔH=-57.3 kJ·mol-1。下列结论正确的是
| A.碳的燃烧热大于110.5 kJ·mol-1 |
| B.①的反应热为221 kJ·mol-1 |
| C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1 |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比7∶17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色.下列判断正确的是( )
| A.金属性:Y>Z |
| B.氢化物的沸点:X>W |
| C.离子的还原性:X>W |
| D.原子及离子半径:Z>Y>X |