设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,33.6LH2O中含有氧原子的数目为1.5NA |
| B.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA |
| C.50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
| D.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
下列有关反应能量变化图像的判断错误的是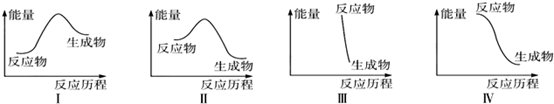
| A.I可表示需加热的放热反应 | B.Ⅱ可表示需加热的放热反应 |
| C.Ⅲ可表示爆炸反应 | D.Ⅳ可表示酸和碱的中和反应 |
已知化学反应2C(s)+O2(g) 2CO(g);2CO(g) + O2(g)
2CO(g);2CO(g) + O2(g)  2CO2(g)都是放热反应。据此推断,下列说法不正确的是(相同条件下)
2CO2(g)都是放热反应。据此推断,下列说法不正确的是(相同条件下)
| A.56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量 |
| B.28gCO所具有的能量一定高于12gC所具有的能量 |
| C.12gC和32gO2所具有的总能量大于44gCO2所具有的总能量 |
| D.将两份等质量碳燃烧,生成CO2的反应比生成CO的反应放出的热量多 |
下列说法或表示方法正确的是
| A.反应物总能量低于生成物总能量时,该反应不能发生 |
| B.强酸跟强碱反应放出的热量称为中和热 |
| C.由石墨比金刚石稳定可知,C(石墨,固)=C(金刚石,固)△H>O |
| D.在101kPa、25℃时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式表示为:2H2(g)十02(g)=2H2O(l);△H=-285.8KJ/mol |
已知反应A+B=C+D的能量变化如图所示,下列说法正确的是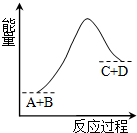
| A.该反应为放热反应 |
| B.该反应为吸热反应 |
| C.反应物的总能量高于生成物的总能量 |
| D.该反应只有在加热条件下才能进行 |
下列物质中含有原子数由多到少排列正确的是
①0.1molH2SO4②4.8g氦气
③5.6L标况下NH3(气体)④4℃时的5.4 mLH2O(密度为1g·mL-1)
| A.①②③④ | B.④③②① | C.②③④① | D.②④③① |