根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题。
| 元素代号 |
I1 |
I2 |
I3 |
I4 |
| Q |
2080 |
4000 |
6100 |
9400 |
| R |
500 |
4600 |
6900 |
9500 |
| S |
740 |
1500 |
7700 |
10500 |
| T |
580 |
1800 |
2700 |
11600 |
| U |
420 |
3100 |
4400 |
5900 |
(1)在周期表中,最可能处于同一族的是( )
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)电解它们的熔融氯化物,阴极放电反应最可能正确的是( )
A.Q2++2e-→Q B.R2++2e-→R
C.S3++3e-→S D.T3++3e-→T E.U2++2e-→U
(3)它们的氯化物的化学式,最可能正确的是( )
A.QCl2 B.RCl C.SCl3 D.TCl E.UCl4
(4)S元素最可能是( )
A.S区元素 B.稀有气体元素 C.p区元素 D.准金属 E.d区元素
(5)下列元素中,化学性质和物理性质最像Q元素的是( )
A.硼(1s22s22p1) B.铍(1s22s2) C.锂(1s22s1)D.氢(1s1) E.氦(1s2)
下图是工业生产硝酸铵的流程。

(1)吸收塔C中通入空气的目的是。A、B、C、D四个容器中的反应,属于氧化还原反应的是(填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=一1266.8kJ/mol
N2(g)+O2(g)=2NO(g)△H=+180.5 kJ/mol
写出氨高温催化氧化的热化学方程式:,氨催化氧化反应的化学平衡常数表达式K=。
(3)已知:N2(g)+3H2(g) 2NH3(g) △H= 一92 kJ/mol。为提高氢气的转化率,宜采取的措施有。(填字母)
2NH3(g) △H= 一92 kJ/mol。为提高氢气的转化率,宜采取的措施有。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率
为。
由铜、银和硝酸银溶液组成的原电池中,负极反应式为,正极反应式为。
在一个小烧杯里,加入20g Ba(OH)2•8H2O粉末,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后加入10gNH4Cl晶体,并立即用玻璃棒搅拌。
(1)试验中玻璃棒的作用是。
(2)写出有关反应的化学方程式,该反应属于反应。
(3)实验中观察到的现象有和反应混合物成糊状。反应混合物呈糊状的原因是。
(4)通过现象,说明该反应为热反应,这是由于反应物的总能量生成物的总能量。
下图是等质量的Na2CO3、NaHCO3粉末分别与足量的
盐酸发生反应时的情景,产生CO2气体的体积较多的A试管中加入的固体试剂是________,当反应结束时,A、B两试管中消耗的盐酸的质量之比为__________。
实验过程中我们还能感受到Na2CO3与盐酸反应时是放热反应,而NaHCO3与盐酸反应时表现为吸热。在A、B两试管中的此反应过程中,反应体系的能量变化的总趋势分别对应于A-____,B-____。(填写a或b)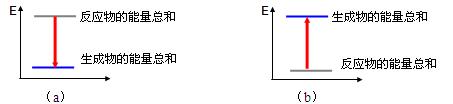
写出下列反应的化学方程式
(1)铜和浓硫酸的反应(2)铜和稀硝酸的反应
(3)非金属C和浓硝酸的反应(4)氯化铁溶液中加入铜粉:
(5)氯化亚铁溶液中通入氯气(6)氢氧化亚铁在空气中被氧化