2012年8月,英国《每日邮报》报道制造太阳镜、婴儿奶瓶、太空杯和光盘的主要材料都是聚碳酸酯,聚碳酸酯在一定条件下可释放出有毒的双酚A(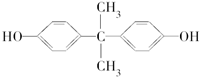 )。聚碳酸酯不耐高温,100℃时释放出的双酚A是25℃时的50倍。双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病。请回答下列问题:
)。聚碳酸酯不耐高温,100℃时释放出的双酚A是25℃时的50倍。双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病。请回答下列问题:
Ⅰ.下列关于双酚A的说法不正确的是________(填序号)。
A.利用聚碳酸酯制成的茶杯来泡茶时对人体无害
B.双酚A的分子式是C15H16O2
C.双酚A的核磁共振氢谱显示有4组峰,且峰面积之比为1∶2∶2∶3
D.1 mol双酚A最多消耗2 mol Br2
Ⅱ.聚碳酸酯(简称PC)是分子链中含有碳酸酯基的高分子聚合物,其合成流程如下: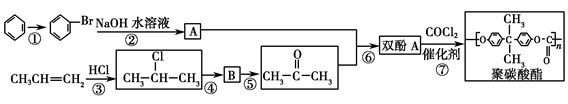
(1)反应①②③④⑤中属于取代反应的有________。
(2)有机物A的结构简式为_________________________________。
(3) 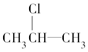 按系统命名法的名称为________。
按系统命名法的名称为________。
(4)CH3CH=CH2与Cl2加成产物的同分异构体有________种(不含加成产物)。
(5)反应⑥的另一产物为________。
(6)写出反应⑤⑦的化学方程式:
反应⑤_________________________________________________________。
反应⑦________________________________________________________,
该反应的反应类型为____________________________________________。
有两瓶pH=2的酸溶液,一瓶是强酸,一瓶是弱酸。现只有石蕊试液、酚酞试液、pH试纸和蒸馏水。简述如何用最简便的实验方法来判断哪瓶是强酸。
KHSO4溶于水或熔化时都会存在的离子是_____________。
下列物质中,属于强电解质的是(),属于弱电解质的是(),属于非电解质的是()。
A碘化钾;B乙醇;C氨气;D蔗糖;E氢硫酸;F硫酸氢钠;G氨水;H液氧;I氢氧化钠溶液
健康人血液中的pH保持在一定范围内变化,这是因为血液中存在如下平衡:H2CO3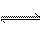
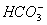 +H+,医学上称为血液酸碱平衡,试解答下列问题:
+H+,医学上称为血液酸碱平衡,试解答下列问题:
(1)蚊虫、蚂蚁等昆虫叮咬人时常向人体血液内注入一种称之为蚁酸(主要成分为HCOOH)的有机酸,HCOOH同CH3COOH一样是一种有机弱酸,写出HCOOH在溶液中电离的方程式:___________________________________。
(2)当人受到蚂蚁叮咬时皮肤上常起小疱,这是因为人体血液中酸碱平衡被破坏所致,若不看医生治疗,过一段时间小疱也会自行痊愈,这是由于血液中又恢复了原先的酸碱平衡,试用平衡移动原理解释上述事实:_____________________________________________________。
有A、B、C三种电解质溶液分别装在三个烧杯中,插有石墨电极,并按图所示方式在电路中连接。闭合开关K后,测得各支路电流强度ⅠⅠ≈ⅠⅡ(其中ⅠⅡ略小)。 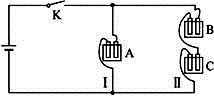
若撤去B,测知电流强度ⅠA<<ⅠC;若撤去C,并将A、B两溶液混匀后均分为两等份,再重置于电路Ⅰ、Ⅱ处,测知通过A、B混合溶液的电流强度与先前通过A溶液的电流强度的相对大小关系为:ⅠsAB>>ⅠA
已知A、B、C分别选自下列溶液:
①0.1 mol·L-1盐酸 ②0.1 mol·L-1醋酸 ③0.1 mol·L-1NaCl溶液 ④0.1 mol·L-1硫酸 ⑤0.1 mol·L-1 NaOH溶液 ⑥0.1 mol·L-1氨水,且25 ℃时,A溶液pH<7
回答下列问题:
(1)指出A、B、C是(或可能是)什么溶液?
A____________;B____________;C____________。
(2)若向C溶液中滴入酚酞试剂呈红色,则C是____________。将A、B、C分别以等体积进行两两混合,结果是哪种组合的混合液中,水的电离程度最大? ____________。(选填“A”“B”“C”)