2SO2(g)+ O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1molSO3(g)的ΔH =" -99" kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1molSO3(g)的ΔH =" -99" kJ·mol-1
请回答下列问题:
(1)图中A表示 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? 加入V2O5后,上述反应ΔH (填变大、不变、变小)
(2)图中ΔH = kJ·mol-1。
(3)如果反应速率v(SO2)为0.06 mol·L-1·min-1,则v(O2)为 mol·L-1·min-1。
(4)已知S(s) + O2(g) = SO2(g) ΔH =" -296" kJ·mol-1,则由S(s)生成5 mol SO3(g)的ΔH= kJ·mol-1。
如图所示,用石墨电极电解氯化铜溶液。查阅资料可知,CuCl42—显黄色,氯化铜溶液显蓝绿色或黄绿色;向体积相同浓度分别为0.01 mol/L、0.05 mol/L、0.1 mol/L、0.5 mol/L的氯化铜溶液中加入NaCl至饱和,对比发现,溶液的颜色由黄绿色向蓝绿色转变。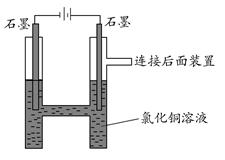
请回答下列问题:
(1)阳极上的气体呈________色,检验该气体可用________________。
(2)写出电解的离子方程式:________________。
(3)实验时,装置中阴极溶液颜色由蓝绿色变为黄绿色,原因是________。
(4)取出阴极的石墨棒,发现表面有浅蓝色固体,试设计实验探究此浅蓝色固体的成分:
____________________________________________________。
(5)为什么要设计连接后面的装置?
______________________________________________________________
铝的阳极氧化是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。
某化学研究小组在实验室中按下列步骤模拟铝表面“钝化”的产生过程。
(1)配制实验用的溶液。要配制200 mL密度为1.2 g/cm3的溶质质量分数为16%的NaOH溶液,需要称取________g NaOH固体。
(2)把铝片浸入热的16%的NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗,写出除去氧化膜的离子方程式:________。
(3)按下图组装好仪器,接通开关K,通电约25 min。在阳极生成氧化铝,阴极产生气体。
写出该过程中的电极反应式:
阳极:_________________________________________;
阴极:_________________________________________。
(4)断开电路,取出铝片,用质量分数为1%的稀氨水中和表面的酸液,再用水冲洗干净。写出该过程发生反应的离子方程式:______________________。
如图甲、乙是电化学实验装置。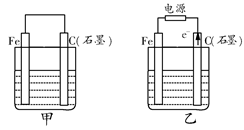
(1)若甲、乙两烧杯中均盛有饱和NaCl溶液。
①甲中石墨棒上的电极反应式为__________________________________;
②乙中总反应的离子方程式为____________________________________;
③将湿润的淀粉-KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。
若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为________________________________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为____________________________________;
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入___________(填写物质的化学式)________g。
某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的开关K时,观察到电流计的指针发生了偏转。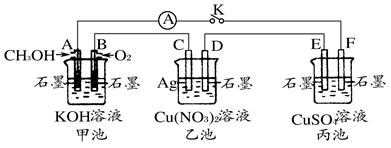
请回答下列问题:
(1)甲、乙、丙三池中为原电池的是__________(填“甲池”、“乙池”或“丙池”)。
(2)丙池中F电极为__________(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应式为__________。
(3)当乙池中C电极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为__________mL(标准状况)。
(4)一段时间后,断开开关K。下列物质能使丙池恢复到反应前浓度的是__________(填选项字母)。
| A.Cu | B.CuO | C.CuCO3 | D.Cu2(OH)2CO3 |
某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,盐桥中装有饱和K2SO4溶液。回答下列问题:
(1)发生氧化反应的烧杯是________(填“甲”或“乙”)。
(2)外电路的电流方向为:从________到________。(填“a”或“b”)
(3)电池工作时,盐桥中的SO42—移向________(填“甲”或“乙”)烧杯。
(4)甲烧杯中发生的电极反应为______________________________。