某科研小组设计出利用工业废酸(稀H2SO4)来浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如下图所示。
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
6.34 |
9.7 |
| Fe3+ |
1.48 |
3.2 |
| Zn2+ |
6.2 |
8.0 |
请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是 。(任写一点即可)
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:
Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)。
(3)物质A最好使用下列物质中的 。
A.KMnO4 B.空气 C.HNO3 D.NaClO
(4)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
(5)物质B可直接用作氮肥,则B的化学式是 。
(6)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂——K2FeO4,写出该反应的离子方程式 。
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示: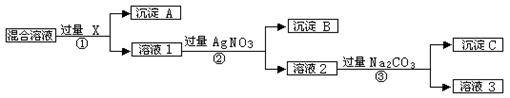
请回答下列问题:
⑴写出实验流程中下列物质的化学式:试剂X :,沉淀A:
⑵上述实验流程中加入过量的Na2CO3的目的是。
⑶按此实验方案得到的溶液3中肯定含有(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的,之后若要获得固体NaNO3需进行的实验操作是(填操作名称)。
我国目前使用碘酸钾作为食用盐中碘强化剂。并规定,食用盐碘含量的平均水平(以碘元素计)为20 mg/kg ~ 30 mg/kg。
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式,并用单线桥标出电子转移。
KIO3+KI+H2SO4=K2SO4+I2+H2O
该反应中的氧化剂是,氧化产物是
(2)已知:I2+2S2O32-=2 I-+S4O62-,某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取20 g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是。
②b中反应所产生的I2的物质的量是mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是mg/kg。(小数点后保留一位有效数字)
A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知
A是一种高熔点物质,B为空气的成分之一,D是一种红棕色固体。请回答下列问题:
(1)固体A的晶体类型为___________,K的化学式为。
(2)C与D在高温下的反应在冶金工业上称为反应,引发该反应的实验操作是
(3)G→J的化学方程式为____________。
(4)A→H的离子方程式为。
(5)I的水溶液pH_____7(填“>”、“<”或“=”),原因是____________(用离子方程式表示)。
(16分)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现一氧化还原反应的体系中,反应物和生成物共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是________,化合价没有发生变化的反应物是____________。
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平):_______________。
(3)上述反应中,1 mol氧化剂在反应中________(填“得到”或“失去”)________mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色。说出NaBiO3的一个性质:_______________________________________________________________________。
(16分)现有A、B、C、D、E可溶于水的五种化合物,其组成的离子如下表,且每种离子只有一次。
| 阳离子 |
Ag+ Na+ Fe3+ Al3+ Ba2+ |
| 阴离子 |
OH- Cl- SO32— NO SO42— |
某同学将它们分别配成0.1 mol·L-1的溶液,进行操作,发现如下实验现象:
①C溶液显黄色,其它溶液均为无色溶液。
②已知向B、C、D、E溶液分别加入A溶液均产生白色沉淀;
③B溶液与适量E溶液反应生成白色沉淀,加入过量E溶液,白色沉淀量减少,但不完全消失。
(1)据此推断它们的化学式:
A__________;B__________;C________;D________;E________。
(2)B溶液加入少量E溶液的离子方程式____________________________________。
(3)向C溶液滴加少量的D溶液的离子方程式_________________________________。