某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:
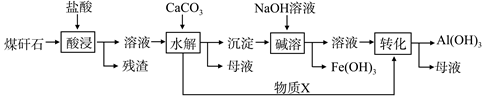
(1)“酸浸”过程中主要反应的离子方程式为__________ 、____________。
(2)“酸浸”时铝浸出率的影响因素可能有_____ ________、_____ ______。(写出两个)
(3)物质X的化学式为___________。“碱溶”时反应的主要离子方程式为:Fe3++3OH- = Fe(OH)3↓; 。
(4)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是 。
(5)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: 。
元素周期表是学习物质结构和性质的重要工具。请参照元素①-⑦在周期表中的位置,回答下列问题:
| ① |
||||||||
| ② |
③ |
④ |
||||||
| ⑤ |
⑥ |
⑦ |
(1)元素⑦在元素周期表的位置为______________,
(2)由原子个数比为1:1:1的①、②、③ 三种元素组成共价化合物X,共形成4对共用电子对,X的结构式为。
(3)⑥的最高价氧化物与⑤的最高价氧化物对应的水化物在溶液中进行的的离子反应方程式_______。
(4)由表中两种元素的原子按1:1组成的离子化合物常用作供氧剂,该化合物中的化学键类型为_____________________。
(5)A、B、D、E是由上述部分元素组成的化合物,它们之间的转化关系如图所示(部分产物已略去)。A、B、D的焰色反应均呈黄色,水溶液均为碱性。请回答: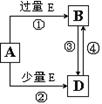
①E的电子式为。
②自然界中存在B、D和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至质量不再发生变化,剩余固体的质量为g。
据报道,一辆盛浓硫酸的槽车,开至某转弯处,由于车速太快,车体倾翻,大量浓硫酸洒满路面.为了减少损害,现有如下方法:①立即调用大量的水冲洗地面;②立即从路基旁边取土将浓硫酸覆盖;③立即调用大量石灰乳覆盖.
你赞成的方法是_____________,不赞成的方法是_____________,理由是_________________。
(1)氢氧化钠俗称苛性钠,其固体必须密封保存,这是因为它不仅能吸收空气里的_______________,而且能跟空气里的__________________反应.
(2)稀释浓硫酸时,一定要把____________沿着器壁慢慢地注入__________________中,并不断搅拌.
要把鸡蛋保存相当长的一段时间,有人提出了四种方法:①放入冰箱中;②放入食盐水中;③放入石灰水中;④煮熟了保存.
你认为最好的方法是______(填序号),你的理由是___________________________________.
现有盐酸、熟石灰、烧碱、食盐四种物质,其中能用于金属除锈的是__________________,能用于改良酸性土壤的是__________________.