(8分)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。
已知:①X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。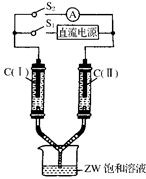
请回答:
(1)Z2Y的化学式是________________________。
(2)Z2Y2与X2Y反应的化学方程式是_______________________________________
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(Ⅰ)的电极名称是________(填写“正极”或“负极”);
C(Ⅱ)的电极反应式是________________________________。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是____________________________________。
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为__________mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_______。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目D.溶液的密度
(3)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(4)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。(保留小数点后1位)
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填“偏大”、“偏小”或“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面。( )
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水。( )
(5)①假设该同学成功配制了0.400 mol·L-1的盐酸,他又用该盐酸中和含0.4 g NaOH的NaOH溶液,则该同学需取________mL盐酸。
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是________。
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
有下列物质:①氢氧化钠固体 ②铜丝 ③盐酸 ④熔融氯化钠 ⑤二氧化碳气体 ⑥氨水 ⑦蔗糖晶体。请用序号填空:
(1)上述状态下可导电的是________。 (2)属于电解质的是________。
(3)属于非电解质的是________。 (4)上述状态下的电解质不能导电的是________。
(1)3.01×1022个OH- 的物质的量为________,质量为________,含有质子的物质的量为________,含有电子的物质的量为________。
(2)相同状况下,10mL X2气体与30mL Y2气体化合生成20mL C气体,则C的化学式为_________。
(3)某地酸雨经检验,除含氢离子外,还有如下离子:c(Na+)=1.4×10-3 mol·L-1,
c(Cl- ) =3.5×10-3 mol·L-1,c(NH4+) =2.3×10-3 mol·L-1, c(SO42-) =1.5×10-3
mol·L-1。则该溶液中氢离子的浓度为_________。
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。
回答下列问题:
(1)在反应②中,每生成2.24L气体G(标准状况)时,该反应转移电子的物质的量是___________mol。
(2)若反应①在加热条件下进行,单质A和化合物B按物质的量之比为1:2发生反应,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是___________________________________________。
(3)若反应①在溶液中进行,A是一元强碱,B是一种酸式盐,D是一种使湿润红色石蕊试纸变蓝的气体,且B遇盐酸能生成使品红溶液褪色的气体。在加热条件下,当A过量时,反应①的离子方程式是_________________________________________。
W、X、y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为________________________________________________________________ 。
(2)W与Y可形成化合物W2Y,该化合物的电子式为________。将等体积、等浓度的W
的最高价氧化物对应的水化物和Y的氢化物混合,其化学方程式为__________________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为_____________________________________________________。
(4)W、X、Y、Z四种元素简单离子的离子半径由小到大的顺序是_______________。