(14分)孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuCl2·3H2O及CaCO3的步骤如下: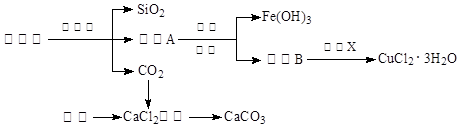
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
| 物质 |
pH (开始沉淀) |
pH(完全沉淀) |
| Fe(OH)3 |
1.9 |
3.2 |
| Fe(OH)2 |
7.0 |
9.0 |
| Cu(OH)2 |
4.7 |
6.7 |
⑴“除杂”时先通入足量Cl2将Fe2+氧化成Fe3+,再加入CuO固体调节溶液的pH至 (填写范围)。检验Fe(OH)3是否沉淀完全的实验方案是 。
⑵操作X包括 、 、过滤和洗涤等。CuCl2·3H2O加热灼烧的最终产物的化学式是 。
⑶某种胃药片的治酸剂为CaCO3,该药片中CaCO3质量分数的测定步骤如下:
a.配制0.1mol·L-1的HCl溶液和0.1mol·L-1的NaOH溶液各250mL。
b.取0.1g磨碎后的胃药于锥形瓶中。
c.向锥形瓶内加入25.00mL 0.1 mol·L-1的HCl溶液。
d.以酚酞为指示剂,用0.1mol·L-1的NaOH溶液滴定,至达到滴定终点。
e.重复bcd三步的操作2次。
①操作c中量取盐酸体积的仪器是 。
②若洗涤后的碱式滴定管未用NaOH溶液润洗,则所测CaCO3的质量分数将 (选填“偏大”、“偏小”或“无影响”)。
③若滴定中NaOH溶液的平均用量为15.00mL,则胃药中碳酸钙的质量分数为 。
某烃A 0.2 mol 在氧气中完全燃烧后,生成CO2、H2O各1.2 mol。试回答下列问题:
(1)烃A的分子式为。
(2)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为。
(3)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,则烃A可能的结构简式有。
其中分子中所有的碳原子都在同一个平面内的物质的系统命名的名称为。
(4)如该烃和溴化氢加成只能生成一种产物,则满足该要求的该烃有种。
(5)如该烃使溴水褪色分子组成含有两个甲基,则满足该要求的该烃有种。
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶有一种溶质,则该溶质是______,上述四种离子浓度的大小顺序为________(填序号);
(2)若四种离子的关系符合③,则溶质为____________________________;
若四种离子的关系符合④,则溶质为____________________________;
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图像正确的是________(填图像符号);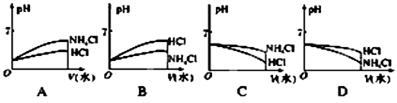
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)________c(OH-)。
(1)在室温下测得0.1mol·L-1氨水PH=11,则该温度下氨水的电离度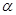 =__________
=__________
(2)25℃时在0.1mol·L-1的H2A水溶液中,用氢氧化钠来调节溶液的pH,得到其中含H2A、HA-、A2-三种微粒的溶液。
①当溶液的pH=7时,c(Na+)=__________(填微粒间量的关系)
②当c(Na+)=c(A2-)+c(HA-)+c(H2A)时溶液为__________溶液(填物质的化学式)。
写出下列反应的化学方程式
(1)乙烯与水反应
(2)异戊二烯发生加聚反应
(3)制取硝基苯
(4)乙醇发生催化氧化反应
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1∆H < 0(I)
NaNO3(s)+ClNO(g) K1∆H < 0(I)
2NO(g)+Cl2(g) 2ClNO(g) K2∆H < 0(II)
2ClNO(g) K2∆H < 0(II)
(1)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)=
mol,NO的转化率а1=。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2а1(填“>”“<”或“=”),平衡常数K2(填“增大”“减小”或“不变”)。若要使K2减小,可采用的措施是。
(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2-)和c(CH3COO‾)由大到小的顺序为。(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数K a=1.7×10-5mol•L‾1),可使溶液A和溶液B的pH相等的方法是。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH