(一)、下列各项分别与哪个影响化学反应速率的因素的关系最为密切?
(1)硫在氧气中比在空气中燃烧剧烈
(2)MnO2加入双氧水中反应更剧烈
(3)同质量的铁片和铁粉与足量的同浓度的盐酸反应,后者先反应完
(4)镁粉在冷水中反应仅有微量气泡逸出,但加热时则有大量气泡产生
(二)、氮化硅是一种新型陶瓷材料,它可由石英晶体与焦炭颗粒在高温的氮气流中,通过如下反应制得:3SiO2 + 6C + 2N2 Si3N4 + 6CO,该反应过程中的能量变化如图所示;回答下列问题:
Si3N4 + 6CO,该反应过程中的能量变化如图所示;回答下列问题: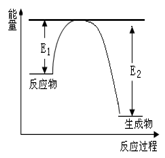
(1)上述反应中的还原剂是 ,还原产物是 。
(2)若反应中测得生成4.48 L CO气体(标准状况下),则转移的电子数为 。
(3)该反应是 (填“吸热”或“放热”)反应。
(三)、在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示: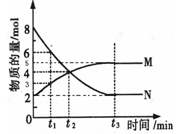
(1)写出该反应的化学方程式为 。
(2)比较t2时刻,正逆反应速率大小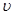 (正)
(正) 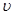 (逆)。(填“>”、“=”、“<”)。.
(逆)。(填“>”、“=”、“<”)。.
(3)若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为 。
(4)t3时刻化学反应达到平衡时反应物的转化率为 。
有关FeSO4的转化关系如下图所示(无关物质已略去)。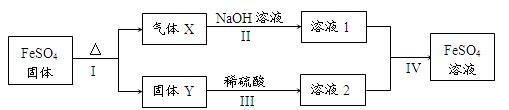
已知:①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,
产生白色沉淀。
②Y是红棕色的化合物。
(1)气体X的成分是(填化学式)。
(2)反应I的反应类型属于(填序号)。
a.分解反应 b.复分解反应 c.置换反应 d.化合反应 e.氧化还原反应
(3)溶液2中金属阳离子的检验方法是。
(4)若经反应I得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol/L NaOH溶液完全吸收,则反应IV中生成FeSO4的离子方程式是。
现有3种化合物A、B、C均含短周期元素R,其转化关系如下图所示。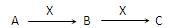
(1)若A由第三周期2种元素组成。常温下,0.1 mol/L X溶液的pH=13,则R在周
期表中的位置是,X中阴离子的电子式是,B转化为C的离子方程式是。
(2)若常温下A、B、C、X均为气态物质,1 mol A中含有共价键的数目约为1.806×1024, X为单质,A与X反应生成B的化学方程式是;在一定条件下,
A可与C反应消除C对大气的污染,该反应的化学方程式是。
氢气是一种清洁能源。用甲烷制取氢气的两步反应的能量变化如下图所示:
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是。
(2)第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始
浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为,CO的平衡转化率为。
常温下,有浓度均为0.1 mol/L的4种溶液:①盐酸;②硫酸;③醋酸;
④氢氧化钡。(注:忽略溶液混合时体积的变化)
(1)将上述溶液两两等体积混合后,溶液pH=7的组合有(填序号)。
(2)醋酸钡是易溶于水的强电解质。将③与④等体积混合,所得溶液中离子浓度由大到小的顺序是。
已知①卤代烃(或 -Br)可以和金属反应生成烃基金属有机化合物。后者又能与含羰基化合物反应生成醇:
-Br)可以和金属反应生成烃基金属有机化合物。后者又能与含羰基化合物反应生成醇: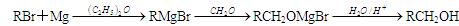
②有机酸和PCl3反应可以得到羧酸的衍生物酰卤:
③苯在AlCl3催化下能与卤代烃作用生成烃基苯: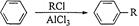
有机物A、B分子式均为C10H14O,与Na反应放出H2并均可经上述反应合成,但却又不能从羰基化合物直接加氢还原得到。A与浓硫酸并加热可得到C1和C2,而B得到D1和D2。C1、D1分子中所有碳原子均可能共处于同一平面上,而C2和D2却不可能。请以最基本的石油产品(乙烯、丙烯、丙烷、苯等)和任选无机试剂为原料依下列路线合成B,合成B的路线为: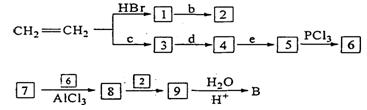
则写出下列物质的结构简式:
A:_____________;B:_____________;C2:_____________;D1:_____________;
1:_____________;2:_____________;3:______________;4:______________;
5:_____________;6:_____________;7:_______________;8:________________;9:______________。