A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2︰3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1) X在周期表中的位置是_____________________________。
(2) 化合物Y2X2的电子式为 ;它含有的化学键类型有 (填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3) A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为_____________________________________。
(4) A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为_____________________________________。
(5) 写出化合物Y2X2与水反应的离子方程式____________________________。
(6) B的最高价氧化物的结构式为____________________________________。
有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A的原子半径最小,B与A能以原子个数1:1、1:2或1:3等组成多种常见化合物;C的最高正价和最低负价的代数和为2;D与F位于同一主族;E与D能以原子个数1:1或2:1形成两种常见化合物.
(1)A与B能形成一种最简单的直线型分子,其电子式为。
(2) CA3极易溶于液态A2D中,其原因 是。
是。
(3)将标准状况下的4.48 L CA3完全溶解在含0.1mol HCl的水溶液中得1L溶液,所得溶液pH=9,其中离子浓度由大到小的顺序是。
(4)物质B2A6D在电解质EDA 的溶液作用下,可形成燃料电池,则该电池的负极反应式为。
的溶液作用下,可形成燃料电池,则该电池的负极反应式为。
(5)E与F形成的化合物属于型化合物(填:离子或共价),用惰性电极电解该化合物的水溶液时,有固体析出,则电解总反应方程式为。
计算题:
已知:晶体“二氧化硅”可由晶体“硅”衍生得到;下图是晶体“硅”及“二氧化硅”的晶胞示意图:
试回答:
(1)请写出SiO2晶体的两种主要用途:
(2)请写出与晶体SiO2化学键及晶体类型完全相同的两种物质的名称:
(3)已知:二氧化硅晶体的密度为ρg/cm3 , 试求二氧化硅晶体中最近的两个Si原子之间的距离的表达式?(保留原表达式,不用化简)
有A、B、C、D、E、F、G七种元素,除E为第四周期元素外其余均为短周期元素。A、E、G位于元素周期表的s区,其余元素位于p区。A、E的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsnnpn+1;D元素形成的一种单质为淡黄色,不溶于水、微溶于酒精、易溶于CS2;F的基态原子核外成对电子数是成单电子数的3倍;G原子有三个电子层,其基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数相同。回答下列问题:
(1)写出下列元素的符号:D,G;(每空2分)
(2)写出基态C原子的轨道表示式:
(3)由A、B、C形成的ABC分子中,含有个σ键,个π键;(每空2分)
(4)由D、E、F、G形成的盐E2DF4、GDF4的共熔体在冷却时首先析出的物质是:(写化学式),原因是;(每空2分)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3p轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D的第一电离能由小到大的顺序为____________________________。
(2)C的氢化物分子是(填“极性”或“非极性”)分子。
(3)化合物BD3的分子空间构型是。
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非
极性溶剂。据此可判断E(CO)5的晶体类型为;E(CO)5在一定条件下发生分解反应:E (CO)5 ="=" E (s) + 5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是。
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞如图所示。
则: 体心立方晶胞和面心立方晶胞的棱长之比为:。(保留比例式,不要求计算结果)
给下列有机物命名: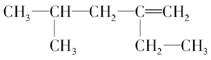
(1)名称: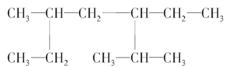
(2)名称: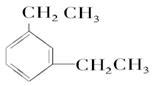
(3)名称: