一定条件下,在容积为10L的密闭容器中,将l mol X和1 mol Y进行如下反应:
2X(g)+Y(g) Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是
Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是
| A.60 s内X的平均反应速率为0.0005 mol·L-1·s-1 |
| B.若温度和体积不变,往容器内增加1 mol X,Y的转化率将增大 |
| C.将容器的容积变为20 L,Z的新平衡浓度将等于原平衡浓度的1/2 |
| D.若升高温度,X的体积分数增大,则正反应的△H>0 |
某探究小组利用丙酮的溴代反应:( )
)
来研究反应物浓度与反应速率的关系。反应速率 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据( )
通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据( )

 分析实验数据所得出的结论不正确的是
分析实验数据所得出的结论不正确的是
A.增大 增大 增大 |
B.实验②和③的 相等 相等 |
C.增大  增大 增大 |
D.增大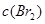 , , 增大 增大 |
对于可逆反应:2A(g)+B(g)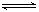 2C(g);△H<0,下列图象正确的是( )
2C(g);△H<0,下列图象正确的是( )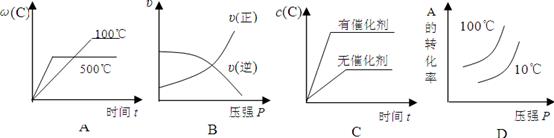
下列叙述不正确的是( )
| A.铁表面镀锌,铁作阳极 |
| B.船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
C.钢铁吸氧腐蚀的正极反应: |
D.工业上电解饱和和食盐水的阴极反应:2H+ +2e –= 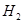 ↑ ↑ |
在密闭容中发生下列反应aA(气) cC(气)+dD(气),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
cC(气)+dD(气),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
| A.平衡向正反应方向移动 | B.A的转化率变小 |
| C.D的体积分数变大 | D.a >c+d |
已知蓄电池在放电时起原电池的作用,充电时起电解池的作用。铅蓄电池在放电和充电 时发生的化学反应可用下式表示:
时发生的化学反应可用下式表示: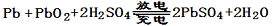
据此判断下列叙述中正确的是 ( )
A.放电时正极电极反应式PbO2 + SO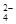 + 2e – + 4 H+= PbSO4 + 2H2O + 2e – + 4 H+= PbSO4 + 2H2O |
| B.充电时蓄电池负极应与电源正极相连接 |
| C.充电时,若要使1mol PbSO4转变为PbO2,则需要通过4mol电子 |
| D.电池放电时,溶液酸性增强 |