(本题共12分)铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图: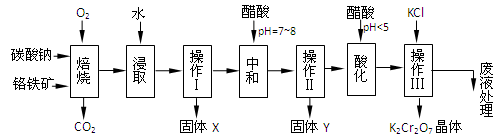
已知:①4FeO·Cr2O3+ 8Na2CO3+ 7O2 8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
②Na2CO3 + Al2O3 2NaAlO2 + CO2↑;③ Cr2O72-+ H2O
2NaAlO2 + CO2↑;③ Cr2O72-+ H2O 2CrO42-+ 2H+
2CrO42-+ 2H+
根据题意回答下列问题:
1.固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。
2.酸化步骤用醋酸调节溶液pH<5,其目的是_________________________________。
3.操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、 、过滤、_______、干燥。
4.下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl →K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是_______________。
5.副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量______(填写试剂)、溶解、过滤、再______(填写试剂)、……灼烧、冷却、称量,得干燥固体m g 。计算样品中氢氧化铝的质量分数为_________(用含m、n的代数式表示)。
6.六价铬有毒,而Cr3+相对安全。工业含铬(CrO3)废渣无害化处理的方法之一是干法解毒,用煤不完全燃烧生成的CO还原CrO3。在实验室中模拟这一过程的装置如下:
CO由甲酸脱水制得;实验结束时熄灭酒精灯的顺序是_________________________。
写出电极反应式:
(1)钢铁的吸氧腐蚀
正极:;负极:。
(2)氢氧燃料电池(稀硫酸作电解质)
正极:;负极。
热化学方程式:
(1)在标准状况下的11.2L甲烷完全燃烧生成CO2和液态水放出444.8KJ热量(298K),其热化学方程式为。
(2)已知断裂下列1mol化学键需要吸收的能量分别为:C="O:745KJ/mol" , O="O:496kJ/mol" , C-H:414KJ/mol 则断裂1molH-O键需要提供的能量为kJ
X、Y、Z均为短周期元素,它们在周期表中的相对位置如右图所示。已知X、Y、Z三元素的质子数之和为40,请回答:
| X |
||
| Y |
Z |
(1)写出X、Y、Z三元素的元素符号
XYZ
(2)Y在周期表中位置
书写化学方程式
(1)2-氯丙烷与氢氧化钠水溶液共热:。
(2)1-丙醇与氧气在催化剂作用下反应。
(3)甲酸与银氨溶液反应。
(4)硬脂酸甘油酯的皂化反应。
(5)乙二醇与乙二酸在一定条件下的缩聚反应。
下图为一个原电池,完成下列问题:
(1)负极材料________,正极材料________,电解质溶液是________。
(2)写出电极反应式:负极:__________________________;
正极:___________________________。