草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。草酸的盐可用作碱土金属离子的广谱沉淀剂。
(1)40 ℃时混合一定体积的0.1mol/L H2C2O4溶液与一定体积0.01mol/L酸性KMnO4溶液,填写表中空格。
| 温度 |
v(H2C2O4) |
v(KMnO4) |
KMnO4褪色时间 |
| 40 ℃ |
10 ml |
10 ml |
40 s |
| 40 ℃ |
20 ml |
20 ml |
|
(2)用甲基橙作指示剂,通过酸碱滴定可测定草酸溶液浓度。甲基橙是一种常用的酸碱指示剂,甲基橙(用化学式HIn表示)本身就是一种有机弱酸,其电离方程式为:HIn H++In—。则酸根离子In—的颜色是 。甲基橙的酸性与草酸相比, (填前者强、前者弱、十分接近、无法判断)。
H++In—。则酸根离子In—的颜色是 。甲基橙的酸性与草酸相比, (填前者强、前者弱、十分接近、无法判断)。
(3)常温下有pH均为3的盐酸和草酸溶液各10 ml,加水稀释,在答题卷上画出稀释过程中两种溶液中c(H+)变化的示意图并作必要的标注。
(4)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5 mol/L时可认为该离子已沉淀完全。现为了沉淀1 L0.01 mol/LMgCl2溶液中的Mg2+,加入100 mL0.1 mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全。
(5)(NH4)2C2O4溶液因NH4+水解程度稍大于C2O42-而略显酸性,0.1 mol/L(NH4)2C2O4溶液pH值6.4。现有某未知溶液,常温下由水电离出的c(H+)=1.0×10-5mol/L,该溶液pH可能是 (填字母)。
A.5 B.6 C.7 D.9
有A、B、C、D、E、F 6种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有3个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示。
请回答下列问题:
(1)E元素原子基态时的电子排布式为________________________________________________________________________。
(2)F的氧化物FO3分子的空间构型为________。
(3)CA3极易溶于水,其原因主要是________________________________________________________________________。
与其最简单分子互为等电子体的阳离子为________。
(4)下列分子结构图中的“ ”表示相关元素的原子中除去最外层电子的剩余部分,“
”表示相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
”表示没有形成共价键的最外层电子,短线表示共价键。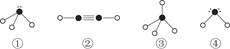
则在以上分子中,中心原子采用sp3杂化形成化学键的是________(填写序号);在②的分子中有________个σ键和________个π键。
(5)从图中可以看出,D与B形成的离子化合物的化学式为________。
(6)图中,若D与B的离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________________________________________________________________________(写出表达式即可)。
许多金属及它们的化合物在科学研究和工业生产中具有许多用途。
回答下列有关问题:
(1)基态Ni的核外电子排布式为__________________________________________,
第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是________。
(2)配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=________,CO与N2结构相似,CO分子内σ键与π键个数之比为________。
(3)NiO、FeO的晶体结构类型均与氯化钠的相同。
①Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________FeO(填“<”或“>”);
②NiO晶体中Ni的配位数为________。
(4)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是________________________________________________________________________________________________________________________________________________,
反应的离子方程式为________________________________________________________________________。
(5)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为________,若该晶胞的边长为a pm,则合金的密度为________g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
据科学家预测:再过100年后,全球气温估计将上升大约1.4~5.8 ℃。根据这一预测,全球气温上升将给全球环境带来不可估测的影响,其中水资源的匮乏将是首当其冲。海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既能解决淡水资源缺乏的问题,又能充分利用海洋资源。
(1)就目前技术而言,结合能源消耗等问题,下列适用于“海水淡化”的技术是(填序号)。
| A.蒸馏法; | B.电渗析法; | C.冷结法; | D.离子交换法;E.反渗透法 |
(2)远古时代就利用海水晒盐,此项技术属于物质分离实验操作中的。
(3)海水晒盐得到的母液中,还有大量的镁、钾离子和一定量的溴、碘化合物。其中通过先进的分离技术得到MgCl2·6H2O产品,此产品还需要在不断通入“干燥氯化氢”的条件下脱水才能得到无水MgCl2,原因是;
如果实验以海水、氯气等为基本原料来制得单质溴、碘,最基本的操作过程是、、。
(4)钛被称为21世纪金属,具有密度小、强度大,不溶于一般的强酸、强碱等优良性能,广泛用于航空、航天以及生物医学等领域。工业上可以用Mg高温还原TiCl4而制得。请设计合理的实验操作,处理上述反应产物,得到纯钛,简述操作过程:。
(1)火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用如图所示的工艺流程生产硫酸。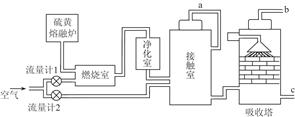
请回答下列问题:
①为充分利用反应放出的热量,接触室中应安装(填设备名称)。吸收塔中填充有许多瓷管,其作用是。
②为使硫黄充分燃烧,经流量计1通入燃烧室的氧气过量50%。为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为。(空气中氧气的体积分数按0.2计),该尾气的处理方法是_。
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是(可多选)。
A.耗氧量减少
B.二氧化硫的转化率提高
C.产生的废气减少
D.不需要使用催化剂
(2)硫酸的用途非常广泛,可应用于下列哪些方面(可多选)。
A.橡胶的硫化
B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产
D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式。
由铝土矿(主要成分是Al2O3)炼制铝的工艺流程示意图如下:
(1)电解生成的铝在熔融液的(填“上层”或“下层”),电解时不断消耗的电极是(填“阴极”或“阳极”)。
(2)写出通入过量二氧化碳酸化时反应的离子方程式
。
(3)电解制备铝时,需加入冰晶石(Na3AlF6),其作用是,工业上可以用氟化氢气体、氢氧化铝和纯碱在高温条件下发生反应来制取冰晶石,写出该反应的化学方程式。
(4)上述工艺所得铝中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池的阴极材料是(填化学式),阳极的电极反应式为。
(5)对金属制品进行抗腐蚀处理,可延长其使用寿命。
①控制一定条件进行电解(见图),此时铝表面可形成耐酸的致密氧化膜,其电极反应式为;
②钢材镀铝后,能防止钢材腐蚀,其原因是。