(12分)合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料。从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g) CO(g)+3H2(g) ⊿H1="+206.1" kJ/mol
CO(g)+3H2(g) ⊿H1="+206.1" kJ/mol
②CH4(g)+CO2(g) 2CO(g)+2H2(g) ⊿H2="+247.3" kJ/mol
2CO(g)+2H2(g) ⊿H2="+247.3" kJ/mol
③CO(g)+H2O(g) CO2(g)+ H2(g) ⊿H3
CO2(g)+ H2(g) ⊿H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得 的物质的量浓度随反应时间的变化如图1所示。10min时,改变的外界条件可能是 。
的物质的量浓度随反应时间的变化如图1所示。10min时,改变的外界条件可能是 。
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的 和
和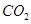 ,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中
,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中 的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中
的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中 的转化率随时间变化的图像。
的转化率随时间变化的图像。
(3)反应③中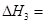 。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时反应③中正、逆反应速率的关系式是 (填代号)。
a. (正)
(正) (逆) b.
(逆) b. (正)<
(正)< (逆) c.
(逆) c. (正)=
(正)= (逆) d.无法判断
(逆) d.无法判断
(4)800K时下列起始体积相同的密闭容器中充入2mol SO2、1mol O2,其反应是2SO2(g)+O2(g)  2SO3(g);△H=-96.56 kJ•mol-1,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。
2SO3(g);△H=-96.56 kJ•mol-1,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。
【1】达到平衡时,平衡常数K (甲) K (乙) K(丙)(填“>”、“<”或“=”)。
【2】达到平衡时SO2的浓度C(SO2)(甲) C(SO2) (乙) C(SO2) (丙)(填“>”、“<”或“=”)。
肉桂醛是一种食用香精,它广泛用于牙膏、洗涤剂、糖果以及调味品中。工业上可通过下列反应制备: +CH3CHO
+CH3CHO
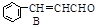 +H2O
+H2O
(1)请推测B侧链上可能发生反应的类型:_____________________________。(任填两种)
(2)请写出两分子乙醛在上述条件下反应的化学方程式:
__________________________________________________________。
(3)请写出同时满足括号内条件下B的所有同分异构体的结构简式:
(①分子中不含碳氧双键和羟基;②是苯的对二取代物;③除苯环外,不含其他环状结构。)
_________________________________________________。
下面是几种有机物的结构简式: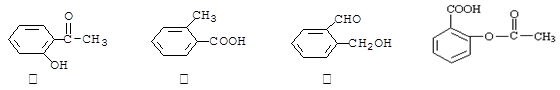
丁
其中,(1)互为同分异构体的有(从甲、乙、丙、丁中选出)。
(2)能与NaHCO3溶液反应的有:;能够发生水解反应的有:。
(3)写出丙中含有的含氧官能团的名称。
(4)请写出鉴别甲的方法(指明所选试剂及主要现象):。
(5)写出丙物质发生银镜反应的化学方程式:。
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
(1)对于反应2SO2(g)+O2(g) 2SO3(g),化学平衡状态的标志为__________。
2SO3(g),化学平衡状态的标志为__________。
| A.SO2减少的化学反应速率和SO3减少的化学反应速率相等 |
| B.容器中气体的平均分子量不随时间而变化 |
| C.容器中气体的分子总数不随时间而变化 |
| D.恒容的容器中气体的密度不随时间而变化 |
(2)450℃时,将amol SO2与bmol O2以3:2通入固定容积5L的密闭容器中,
①反应进行至10min时,测得n(SO2) =" 8mol" ,n(SO3) ="4mol" , 则b=_______mol
②10min内平均速率v(SO2)=___________________
③反应达平衡后,测得容器内压强是反应起始压强的0.715倍,则平衡时的SO2转化率为___________________.
A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻;C与E同主族;A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个; F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红。
(1)E在周期表中的位置为__________________________;D的最高价氧化物的水化物的电子式___________________________。
(2)B、C的氢化物稳定性顺序为(用分子式表示,由大到小)_________>__________。
(3)B的氢化物和B的最高价氧化物的水化物反应生成Z,则Z的名称为____________________,Z的化学键类型为____________________。
(4)两种均含C、D、E、F四种元素的化合物相互反应放出气体的反应离子方程式为_____________________________________。
(5)一定量的D2C2与AC2反应后的固体物质,恰好与含0.8mol HCl的稀盐酸完全反应,并收集0.35 mol 气体,则固体物质的组成为(写清成分和物质的量)____________________。
氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是由转化为,在导线中电流方向为→(用a、b 表示)。
(2)正极反应式为,负极发生反应(填“氧化”或“还原”)。
(3)氢氧燃料电池的能量转化率100%(填<、>、=)。
(4)电极表面镀铂粉的原因为。