某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验: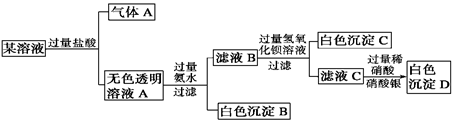
下列说法不正确的是 ( )
| A.原溶液中一定存在Na+、AlO2-、CO32-、SO42-离子 |
B.气体A的化学式是CO2,其电子式为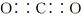 |
| C.原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+ |
| D.生成沉淀B的离子方程式为:Al3++3OH-===Al(OH)3↓ |
向含有1 mol明矾的溶液中逐滴加入Ba(OH)2溶液,充分反应,下列说法不正确的是( )
| A.当Al3+恰好完全沉淀时,消耗Ba(OH)2 1.5 mol |
| B.当SO42-恰好完全沉淀时,Al3+全部转化为Al(OH)3 |
| C.当向溶液中加入1.5 mol Ba(OH)2时,反应可用下列离子方程式表示: 2Al3++3SO42-+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓ |
| D.随着加入的Ba(OH)2的物质的量不断增大,沉淀的物质的量不断增大 |
某工厂用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程如下,下列说法中,错误的是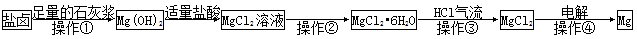
| A.操作①发生的反应为氧化还原反应 |
| B.若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器 |
| C.操作②是蒸发浓缩结晶 |
| D.在整个制备过程中,未发生置换反应 |
能够大量共存的离子组是:
| A.强碱性溶液中:Na+、K+、SO42-、AlO2- |
| B.含有0.1 mol·L-1Fe3+的溶液中:K+、Mg2+、Cl-、SCN- |
| C.某无色溶液中:NH4+、Fe2+、MnO4-、NO3- |
| D.与铝反应生成H2的溶液中:Na+、K+、Cl-、SO42- |
6.4 g铜跟60 mL 8mol/L的硝酸充分反应,硝酸的还原产物有NO、NO2。铜完全溶解后,测得溶液中H+的物质的量为n mol,此时溶液中所含NO3-的物质的量为 ( )
| A.(n+0.2) mol | B.(n+0.4) mol | C.0.28 mol | D.0.31 mol |