1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是 (选填“A”、“B”或“C”);
(2)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ;(图中为1molNO2与1molCO的反应)
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。
①在体系中加入催化剂对反应热是否有影响? (填“是”或“否”),原因是 。
②在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 ,E2 。(填“增大”、“减小”或“不变”)
③请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图:
在下列物质中:①SiO2②NaOH③Na2S④H2O2⑤Na2O2⑥(NH4)2S⑦CO2⑧CCl4⑨C2H4⑩金刚石。用序号填空:
(1)只含有离子键的是______________________________________;
(2)既含有离子键,又含有极性共价键和配位键的是____________;
(3)既含有离子键又含有非极性共价键的是____________________;
(4)含有极性共价键和非极性共价键的非极性分子是____________;
(5)含有极性共价键和非极性共价键的极性分子是_______________;
(6)熔化时只破坏极性共价键的是_____________________________。
把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)===nZ(g)+6W(g);2 min末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为____________________;2 min末时Y的浓度为________________;化学方程式中n的值是________。
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
| 编号 |
操作 |
实验现象 |
| ① |
分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 |
试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
| ② |
另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 |
试管A、B中均未明显见到有气泡产生。 |
(1)过氧化氢分解的化学方程式为__________________________________________。
(2)实验①的目的是______________________________________________________。
实验中滴加FeCl3溶液的目的是_________________________________________。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是__________________________________(用实验中所提供的几种试剂)。
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,则A、B、C三点所表示的瞬时反应速率最快的是______________________。
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如下图所示装置。试回答下列问题: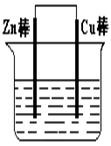
(1)若电解质溶液为稀硫酸,则Zn棒为原电池的极,可观察到Cu棒的所产生现象是,写出该电极反应式:。
(2)若电解质为硫酸铜溶液,则Cu棒上发生反应,Zn棒上发生反应的电极反应式为:。
下表是元素周期表的一部分,回答下列问题:
| 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
③ |
④ |
||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
 |
 |
(1)写出③、⑤两种元素形成的化合物有两种,化学式是:,。
(2)上面主族元素中原子半径最大的是,非金属性最强的是。
(3)这些元素的最高价氧化物的水化物中,酸性最强的是___________(填化学式,下同);碱性最强的是________;能形成两性氢氧化物的元素是________。