下表是元素周期表的一部分,回答下列问题:
| 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
① |
② |
③ |
④ |
|
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
 |
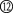 |
(1)写出③、⑤两种元素形成的化合物有两种,化学式是: , 。
(2)上面主族元素中原子半径最大的是 ,非金属性最强的是 。
(3)这些元素的最高价氧化物的水化物中,酸性最强的是___________(填化学式,下同);碱性最强的是________;能形成两性氢氧化物的元素是________。
请回答以下问题:
(1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元素对应原子的M层电子排布式为.
(2)如下图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是.简述你的判断依据.
(3)CO2在高温高压下所形成的晶体其晶胞如下图3所示.该晶体的类型属于(选填“分子”“原子”“离子”或“金属”)晶体,该晶体中碳原子轨道的杂化类型为。
(4)在离子晶体中正、负离子间力求尽可能多的接触,以降低体系的能量,使晶体稳定存在。已知Na+半径是Cl-的a倍,Cs+半径是Cl-的b倍,请回顾课本上NaCl和CsCl的晶胞,其晶胞边长比为.
(5)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A-D图中正确的是.铁原子的配位数是,假设铁原子的半径是r cm,该晶体的密度是p g/cm3,则铁的相对原子质量为(设阿伏加德罗常数的值为NA)。
如图是现今常规生产发烟硫酸和硫酸的流程图:
(1)在④处二氧化硫被氧化成三氧化硫,④的设备名称是.该处发生反应的方程式为.为提高三氧化硫的产率,该处应采用(填“等温过程”或“绝热过程”)为宜.
(2)在⑦处进行二次催化处理的原因是.
(3)⑤处气体混合物主要是氮气和三氧化硫.此时气体经过⑥后不立即进入⑦是因为:.
(4)20%的发烟硫酸(SO3的质量分数为20%)1吨需加水吨(保留2位有效数字)才能配制成98%的成品硫酸.
(5)在②处发生1500℃的“不完全燃烧”,即先混入少量干燥空气,然后在③处于700℃下再继续燃烧.试简述这种燃烧方式对环境保护是有利的原因.
工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。
(1)某温度下,2SO2(g)+O2(g) 2SO3(g)△H="-197" kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K=,升高温度K将(填“增大、减小或不变”)。
2SO3(g)△H="-197" kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K=,升高温度K将(填“增大、减小或不变”)。
(2)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2,发生下列反应: 2SO2(g)+O2(g) 2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是(填字母)。
2SO2(g)+O2(g) 2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是(填字母)。
A.恒温恒容,充入2mol SO3 B.恒温恒容,充入2mol N2
C.恒温恒压,充入1 mol SO3 D.升高温度
(3)在一密闭容器中进行下列反应:2SO2(g)+O2(g) 2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是(填字母)。
2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是(填字母)。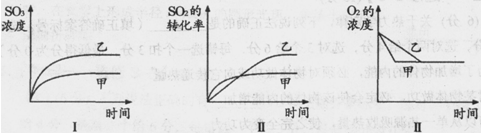
A.图Ⅰ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且乙的温度较低
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
(4)某实验小组设想如下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
SO2(g)+O2(g) 2SO3(g)△H1="-197" kJ/mol;
2SO3(g)△H1="-197" kJ/mol;
H2O(g)=H2O(1)△H2="-44" kJ/mol:
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(1) H3="-545" kJ/mol。
写出SO3(g)与H2O(1)反应的热化学方程式是。
(6)由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种沉淀共存时,SO42-和CO32-的浓度之比。[已知该温度时,Ksp(BaSO4)=1.3x10-10,KsP(BaCO3)=5.2x10-9]。
某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS),共同生产MnO2和Zn(干电池原料)。
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
②IV中的电解反应式为MnSO4+ZnSO4+2H2O  MnO2+Zn+2H2SO4。
MnO2+Zn+2H2SO4。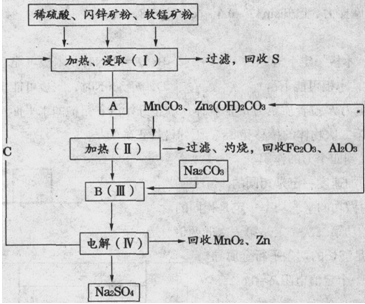
(1)A中属于还原产物的是。
(2)MnCO3、Zn2(OH)2CO3的作用是;Ⅱ需要加热的原因是;C的化学式是。
(3)Ⅲ中发生的离子方程式为,;
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是。
短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。请回答:
(1)X氢化物的电子式是_________________________________________。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈(填“酸”、“碱”或“中”)性,用离子方程式表示其原因是_____________________________________.
(3)Y—AgO电池是应用广泛的鱼雷电池,其原理如图所示。
该电池的负极反应式是___________________________________。
(4)Z和W比较,非金属性较弱的是_______________(填元素符号),下列不能验证这一结论的是________(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.断开氢化物中1 mol H—Z或H—W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性