下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
| |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|
||||||
| 2 |
|
|
|
D |
E |
K |
G |
|
| 3 |
B |
|
C |
J |
F |
|
H |
I |
(1)表中元素,化学性质最不活泼的是 ;可用于制半导体材料的元素是_______; 非金属性最强的是 。
(2)最高价氧化物的水化物碱性最强的是 ,该物质的水溶液与C最高价氧化物的水化物反应的离子方程式是
H最高价氧化物的水化物是
(3)由A、K两种元素组成的含10个电子的化合物的结构式是 ,
B的氧化物的电子式是 ,该氧化物属于 晶体。
(15分) [选修5—有机化学基础]扁桃酸衍生物是重要的医药中间体,以A和B 为原料合成扁桃酸衍生物F路线如下:
(1)A的分子式为C2H2O3,可发生银镜反应,且具有酸性,A所含官能团名称为:_________,写出A+B→C的化学反应方程式为____________。
(2) 中①、②、③(从左到右编号)3个—OH的酸性由强到弱的顺序是:_______。
中①、②、③(从左到右编号)3个—OH的酸性由强到弱的顺序是:_______。
(3)E是由2分子C生成的含有3个六元环的化合物,E的分子中不同化学环境的氢原子有_____种。
(4)D→F的反应类型是__________,1mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为:________mol。
(5)写出符合下列条件的F的所有同分异构体(不考虑立体异构)的结构简式:______________。
①属于一元酸类化合物;
②苯环上只有2个取代基且处于对位,其中一个是羟基。
(15分)[选修3—物质结构与性质]钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:
(1)钒在元素周期表中的位置为 ,其价层电子排布图为 。
(2) 钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为 、 。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是 对,分子的立体构型为 ;SO3气态为单分子,该分子中S原子的杂化轨道类型为 ;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为 ;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为 (填图2中字母),该分子中含有 个σ键。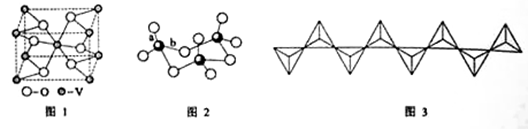
(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为 ;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为 ____ 。
(15分) [选修2—化学与技术]氨气是工农业生产中重要的产品,合成氨并综合利用的某些过程如下图所示:
(1)原料气中的氢气来源于水和碳氢化合物。请写出甲烷和水在催化剂和高温条件下反应的方程式: 。
(2)在工业生产中,设备A的名称为 ,A中发生的化学反应方程式是 。
(3)上述生产中向母液通入氨气同时加入 ,可促进副产品氯化铵的析出。长期使用氯化铵会造成土壤酸化,尿素适用于各种土壤,在土壤中尿素发生水解,其水解的化学方程式是 。
(4)纯碱在生产生活中有广泛的应用,请写出任意两种用途: 。
(5)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数。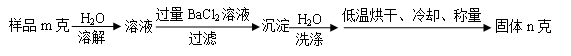
①检验沉淀是否洗涤干净的方法是_____________。
②样品中NaCl的质量分数的数学表达式为________________。
(9分) 粉煤灰中含有SiO2、Al2O3、Fe2O3等,某实验室对其进行处理的流程如图所示: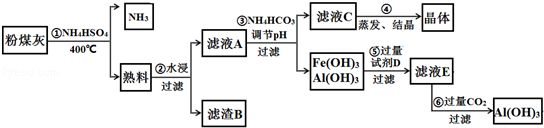
回答下列问题:
(1)第①步得到的“熟料”中可溶性的成分主要是NH4Fe(SO4)2、NH4Al(SO4)2等,写出生成NH4Fe(SO4)2的化学方程式 。在物质分类体系中,NH4Fe(SO4)2、NH4Al(SO4)2不属于 (填字母)。
a.硫酸盐 b.复盐c.强电解质d.共价化合物
(2)滤渣B的主要成分为 。
(3)已知Ksp[Fe(OH)3]=4×10-38,Ksp [Al(OH)3]=1×10-32。为实现步骤③的实验目的,应使溶液中c(Fe3+)、c(Al3+)均小于或等于1×10-5 mol•L﹣1可认为完全沉淀,则溶液A至少应调节到pH=___。
(4)实验室进行第④步操作时,所需的主要仪器是酒精灯、三脚架、 、 ,得到的晶体主要成份是 (填化学式)。
(8分) 乙苯催化脱氢制苯乙烯反应: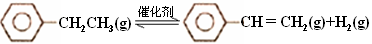
(1)已知:
| 化学键 |
C-H |
C-C |
C=C |
H-H |
| 键能/kJ·molˉ1 |
412 |
348 |
612 |
436 |
计算上述反应的△H=________ kJ·mol-1。
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数Kp=___________(用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实 ___________。
②控制反应温度为600℃的理由是____________。