(15分) [选修2—化学与技术]氨气是工农业生产中重要的产品,合成氨并综合利用的某些过程如下图所示:

(1)原料气中的氢气来源于水和碳氢化合物。请写出甲烷和水在催化剂和高温条件下反应的方程式: 。
(2)在工业生产中,设备A的名称为 ,A中发生的化学反应方程式是 。
(3)上述生产中向母液通入氨气同时加入 ,可促进副产品氯化铵的析出。长期使用氯化铵会造成土壤酸化,尿素适用于各种土壤,在土壤中尿素发生水解,其水解的化学方程式是 。
(4)纯碱在生产生活中有广泛的应用,请写出任意两种用途: 。
(5)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数。
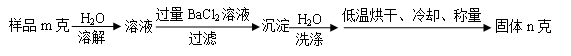
①检验沉淀是否洗涤干净的方法是_____________。
②样品中NaCl的质量分数的数学表达式为________________。
磷化铝是用红磷和铝粉烧制而成。因杀虫效率高、经济方便而应用广泛。可作粮仓熏蒸的磷化铝片,熏蒸每吨粮食只需3~5片(3.20g/片)。
(1)写出磷化铝的化学式:________;举一例红磷的同素异形体,写出其化学式:________。
(2)磷化铝毒性主要为遇水、酸时则迅速分解,放出吸收很快、毒性剧烈的磷化氢气体,写出磷化铝
和水反应的化学方程式:____________________________________________________________。
(3)磷化氢是一种无色、剧毒、易燃的气体,该气体比空气重并有类似臭鱼的味道,其结构和NH3相似,写出磷化氢的电子式:________;磷化氢具有强的还原性,通入硫酸铜溶液中会生成单质铜和磷酸,写出该反应的离子方程式:___________________________________________。
(4)磷化氢在空气中的最高允许值为0.3ppm,空气中超标的PH3气体可以用重铬酸钾、活性炭、氢碘酸处理,你认为他们的反应原理是否相同,原因是____________________________________。
(5)磷的含氧酸很多,H3PO4是常见的一种,多个磷酸分子通过脱水作用由O原子连接而成为多磷酸,三聚磷酸钠(Na5P3O10·6H2O)是常见的多磷酸盐,该盐373K时,可发生如下反应Na5P3O10·6H2O="==" Na3HP2O7+X+5H2O,请你推出X的化学式:__________________;并且写出X溶液中离子电荷守恒的等式:___________________________。
废旧显示屏玻璃种含有SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得Ce(OH)4和硫酸铁铵矾[Fe2(SO4)3·(NH4)2SO4·24H2O],流程设计如下:
已知:Ⅰ.酸性条件洗,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;
Ⅱ.CeO2不溶于稀硫酸,也不溶于氢氧化钠溶液。
回答以下问题:
(1)反应②中过氧化氢的作用是 。
(2)反应③的离子方程式是 。
(3)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:
2 Ce3+(水层)+6HT(有机层) ≒2 CeT3 (有机层) +6H+(水层)
从平衡角度解释:向CeT3(有机层)加入硫酸获得较纯的含Ce3+的水溶液的原因是 。
(4)硫酸铁铵矾[Fe2(SO4)3·(NH4)2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是 。
(5)相同物质的量浓度的以下三种溶液中,铵根离子浓度由大到小的顺序是 。
a.Fe2(SO4)3·(NH4)2SO4·24H2O b.(NH4)2SO4 c.(NH4)2CO3
(6)用滴定法测定制得的Ce(OH)4产品纯度。
若所用硫酸亚铁溶液在空气中露置一段时间后再进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”);称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量氢氧化钠溶液,过量洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L硝酸钡溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为 。
钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如下表;
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
上述盐溶液中的阴离子,结合氢离子能力最强的是 ,根据表中数据,浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最大的是 (填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:
① ② (填“>”“=”“<”下同)。溶液中阴离子的物质的量浓度之和:① ②。
(3)碳酸氢钠是一种 (填“强”或“弱”)电解质;写出HCO3-水解的离子方程式: ,常温下,0.1mol/L碳酸氢钠溶液的pH大于8,则溶液中Na+、HCO3-、H2CO3、CO32-、OH-五种微粒的浓度由大到小的顺序为: 。
(4)实验室中常用氢氧化钠来进行洗气和提纯。
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为: 。
② 几种离子开始沉淀时的pH如下表:
| 离子 |
Fe2+ |
Cu2+ |
Mg2+ |
| pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度的Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时, (填离子符号)先沉淀,Ksp[Fe(OH)3]
Ksp[Mg(OH)2] (填“>”“=”或“<”),要使0.2mol/L硫酸铜溶液中铜离子沉淀较为完全(使铜离子浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 。
( Ksp[Cu(OH)2]=2×10-20mol2/L2)
甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,二氧化碳加氢合成甲醇是合理利用二氧化碳的有效途径。由二氧化碳制备甲醇过程中可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g)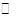 CH3OH(g)+H2O(g) △H1=-49.58KJ/mol
CH3OH(g)+H2O(g) △H1=-49.58KJ/mol
反应Ⅱ:CO2(g)+H2(g)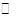 CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)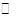 CH3OH(g) △H3=-90.77KJ/mol
CH3OH(g) △H3=-90.77KJ/mol
回答下列问题:
(1)反应Ⅱ的△H2= ,反应Ⅰ自发进行条件是 (填“较低温”、“较高温”或“任意温度”)。
(2)在一定条件下3L恒容密闭容器中,充入一定量的氢气和二氧化碳仅反应反应Ⅰ,实验测得反应物在不同起始投入量下,
体系中二氧化碳的平衡转化率与温度的关系曲线,如图1所示。
① 氢气和二氧化碳的起始的投入量以A和B两种方式投入
A:n(H2)=3mol n(CO2)=1.5mol
B:n(H2)=3mol n(CO2)=2mol,曲线Ⅰ代表哪种投入方式 (用A、B表示)
②在温度为500K的条件下,按照A方式充入3摩尔氢气和1.5摩尔二氧化碳,该反应10分钟时达到平衡:A.此温度下的平衡常数为 ;500K时,若在此容器中开始充入0.3摩尔氢气和0.9摩尔二氧化碳、0.6摩尔甲醇、x摩尔水蒸气,若使反应在开始时正向进行,则x应满足的条件是 。
b.在此条件下,系统中甲醇的浓度随反应时间的变化趋势如图2所示,当反应时间达到3分钟时,迅速将体系温度升至600K,请在图2中画出3~10分钟内容器中甲醇的浓度变化趋势曲线。
(3)固体氧化物燃料电池是一种新型的燃料电池,它是以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,该电池的工作原理如图3所示,其中多孔电极均不参与电极反应。图3是甲醇燃料电池的模型。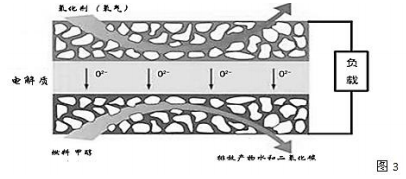
①写出该燃料电池的负极反应式 。
②如果用该电池作为电解装置,当有16g甲醇发生反应时,则理论上提供的电量最多为 摩尔。
某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下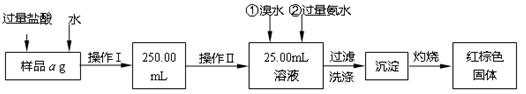
步骤进行:
Ⅰ.请根据上面流程,回答以下问题:
(1)操作Ⅰ所用的玻璃仪器除烧杯、玻璃棒外,还必须有 、 ,(填仪器名称)。
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是 ;若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是 。
Ⅱ.有同学提出,还可以采用以下方法来测定:
(1)溶解样品改用了硫酸,而不再用盐酸,为什么?
(2)选择的还原剂时否能用铁 (填“是”或“否”),原因是: 。
(3)若滴定用掉cmol/L高锰酸钾溶液bmL,则样品中铁元素的质量分数是 。