2014年8月28日,第二届夏季青年奥林匹克运动会(以下简称“青奥会”)在南京奥体中心顺利闭幕。请完成下列与“青奥会”有关的填空。
(1)随着“青奥会”的举行,各种与城市建设相关的新材料接连不断地展现出来。
①体育场馆需用大量的建筑材料。下列材料不属于硅酸盐材料的是 (填字母)。
a.石灰石 b.水泥 c.玻璃
②轨道交通建设需大量金属材料。下列金属材料最易发生腐蚀的是 (填字母)。
a.铝合金 b.钢铁 c.纯铜
③聚乙烯、聚氯乙烯都是线型高分子树脂,它们制成的塑料具有 (选填“热塑性”或“热固性”)。
(2)“青奥会”期间,要保障运动员的营养与健康。
①及时补充体能是运动员取得优秀成绩的基本保证。氨基酸是组成蛋白质的基本单元,其分子中所含官能团是氨基和 (填名称);脂肪在人体内水解的产物是高级脂肪酸和 (填名称)。
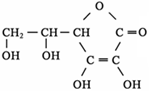
②运动员还要合理吸收维生素。维生素C的结构简式如图所示,其分子式为 ;在氯化铁溶液中加入维生素C后,溶液由黄色转变为浅绿色,说明维生素C具有较强的 性(填“氧化”或“还原”)。
③服用违禁药物不仅妨碍体育竞技的公平、公正,也有害运动员的身心健康。在阿司匹林、青霉素、麻黄碱、小苏打等常用药物中,参赛选手不可服用的是 。
(3)“绿水蓝天”工程为运动员提供了优良的环境,向世界展示了古都南京的美好形象。
①用明矾处理废水中细小悬浮颗粒的方法属于 (填字母)。
a.混凝法 b.中和法 c.氧化还原法
②PM2.5悬浮于大气中的直径≤2.5 μm(微米)的颗粒物,大量PM2.5会造成灰霾天气。燃煤气化有助于控制PM2.5排放,写出焦炭与水蒸气反应的化学方程式 。
③向煤中加入石灰石作为脱硫剂,可以减少SO2的排放,生成CaSO4。发生的总反应化学方程式为 。
A和B两种物质的分子式都是C7H8O,它们都能跟金属钠反应放出氢气。A不溶于NaOH溶液,而B能溶于NaOH溶液,B能使适量溴水褪色,并产生白色沉淀,A不能。B的一溴代物有两种结构,写出A和B的结构简式________________和名称_________________。
A、B、C、D四种有机分子中碳原子数相同,A为气态,标准状况下的密度为1.16 g·L-1,B或D跟HBr反应都生成C,D在浓H2SO4存在下发生消去反应生成B,则:
(1)A、B、C、D的结构简式分别为:A_________,B_________,C_________,D_________。
(2)写出下列各步反应的方程式:
B→C_________________________________;
D→C_________________________________;
D→B_________________________________。
某物质的分子式为C4H10O。
(1)它能被催化氧化生成相同碳原子数的醛有_________种,它们对应的醇分别为(写结构简式) ___________,___________。
(2)它能被催化氧化成相同碳原子数的酮有种,写出结构简式并命名___________,___________。
(3)不能被催化氧化的醇的结构简式和名称___________,___________。
(4)能发生消去反应,有机产物只有一种物质的有_________种;两种的有_________种,产物的结构简式为_________和_________。
有机物结构理论中,若一个碳原子同时含有两个羟基时,结构很不稳定,会自动脱水生成相应的醛: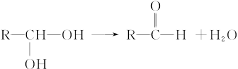
试写出甲烷与氯气光照后生成的一系列有机物中,在一定条件下与NaOH溶液共热后生成物的结构简式为:①____________,②____________,③____________,④____________。
已知:同一个碳原子上连有两个羟基时不稳定,会自动失水,即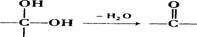
 是化合物
是化合物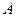 的四种同分异构体,它们的相对分子质量不超过l80.分子中只含碳、氢、氧三种元素,其中氧的质量分数为31.58%。实验表明:
的四种同分异构体,它们的相对分子质量不超过l80.分子中只含碳、氢、氧三种元素,其中氧的质量分数为31.58%。实验表明: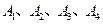 均是只有一个侧链的芳香族化合物,它们均含有醇羟基,并可以进行如下反应,产物中
均是只有一个侧链的芳香族化合物,它们均含有醇羟基,并可以进行如下反应,产物中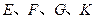 均为芳香族化合物。
均为芳香族化合物。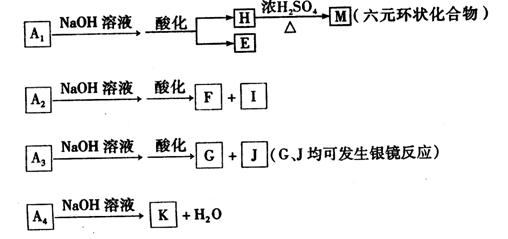
(1)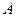 的相对分子质量为,分子式为。
的相对分子质量为,分子式为。
(2)写出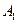 、
、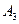 ,的结构简式。
,的结构简式。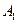 ;
;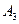 。
。
(3)写出由 生成
生成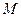 的化学反应方程式,反应类型为。
的化学反应方程式,反应类型为。
(4)现有如下试剂:稀盐酸、稀硫酸、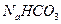 ,溶液和
,溶液和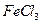 ,溶液。从中选择合适试剂,简述鉴别
,溶液。从中选择合适试剂,简述鉴别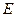 和
和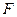 溶液的实验操作方法、现象及结论。
溶液的实验操作方法、现象及结论。