依据图1和图2的有关信息,回答问题:
(1)图1是向氢氧化钠溶液中逐滴加入盐酸时,溶液温度与盐酸溶液体积之间的变化关系图。由图1可知,该反应是 (填“放热”或“吸热”),M点所表示的含义是 。
(2)图2是向碳酸钠溶液中逐滴加入盐酸时其反应过程的图像,由图像可知该反应分两步完成。第一步:Na2CO3+HCl=NaHCO3+NaCl,当盐酸的体积大于 ml时进行第二步,此时,反应的化学方程式是 ,当盐酸的体积大于V2ml时,溶液中的溶质是 。
下图是木炭还原氧化铜的实验装置图,按要求回答下列问题。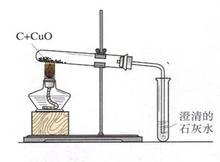
(1)酒精灯加网罩的目的 ;
(2)刚开始加热,澄清的石灰水中立即产生气泡,但澄清的石灰水不变浑浊,原因是 ;
(3)继续加热,观察到的现象: ; 。
(4分) 某化学小组同学,用如下图所示实验探究质量守恒定律。
(1)充分反应冷却后,天平仍然平衡的是(填写字母序号)还有什么现象:
该反应的化学方程式为
(2)由上述实验可知,在化学反应前后,一定不变是是 (填数字序号)。
①原子种类②原子数目③分子种类④分子数目⑤元素种类⑥物质种类
如图为通电分解水的简易装置,据图分析:
(1) 与A试管中的电极相连接的是电池的极,右边试管B中产生的气体是。
(2) 如果用VA和VB分别表示A试管和B试管中生成气体的体积,则VA︰VB,约等于。(3)写出该实验所发生反应的文字表达式:。
已知空气的主要成分是氮气和氧气。某课外活动小组设计了测定空气中氧气含量的实验,实验装置如图所示。
(1)红磷在集气瓶中发生反应的文字表达式为:
该实验中红磷需稍过量。目的是。
(2)待燃烧停止,白烟消失并冷却后,打开止水夹,观察到烧杯中的水进入集气瓶,瓶内水面最终接近刻度1处。由此可知,氧气约占空气总体积的。由本实验还可推知氮气的哪一些性质?试写出其中的一种:
根据下列实验装置图,回答问题
A BCDE
(1)写出装置中标号仪器的名称1. 2.3.
(2)实验室常用氯酸钾和二氧化锰制取氧气,可选用的发生装置是可选用的收集装置是(填字母)在加入药品之前应先检查装置,写出该反应的文字表达式 .
(3) 实验室用过氧化氢溶液和二氧化锰制取干燥氧气,可选用的装置是(填字母)怎么知道氧气收集满了写出该反应的文字表达式:。