下表是元素周期表的一部分,请回答有关问题:
|
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
||
| 2 |
|
|
|
① |
② |
|
③ |
|
||
| 3 |
|
④ |
⑤ |
|
|
⑥ |
⑦ |
⑧ |
||
| 4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式 。
(3)④元素与⑦元素形成化合物的电子式 。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 (填化学式)。
(5)③元素与⑩元素两者核电荷数之差是 。
通过煤的气化和液化,使碳及其化合物得以广泛应用。
I.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向1L恒容密闭容器中充人CO和H2O(g),800℃时测得部分数据如下表。
| t/min |
0 |
1 |
2 |
3 |
4 |
| n(H2O)/mol |
0.600 |
0.520 |
0.450 |
0.350 |
0.350 |
| n(CO)/mol |
0.400 |
0.320 |
0.250 |
0.150 |
0.150 |
则该温度下反应的平衡常数K=。
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1 H2,
此时υ(正)υ(逆) (填“>” “="”" 或 “<”)。
II.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283 kJ·mol-1、286 kJ·mol-1、726 kJ·mol-1'。
(3)利用CO、H2合成液态甲醇的热化学方程式为。
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响。
III。为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示: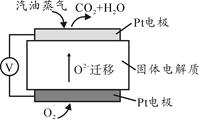
一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2—。
(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式。
(6)已知一个电子的电量是1.602×10—19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOHg。
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一。
(7)将CO2转化成有机物可有效地实现碳循环。如:
a.6CO2+6H2O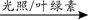 C6H12O6+6O2
C6H12O6+6O2
b.2CO2 + 6H2 C2H5OH +3H2O
C2H5OH +3H2O
c.CO2 + CH4 CH3COOH
CH3COOH
d.2CO2 + 6H2 CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
以上反应中,最节能的是,反应c中理论上原子利用率为。
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH、Cl-、CO、SO,现分别取100 mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、干燥、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65 g固体。
依据实验回答下列问题:
(1)由①可知一定存在的离子为,其浓度为mol·L-1。
(2)写出②中产生沉淀的离子方程式。
(3)由③可知一定存在的离子为,其浓度为mol·L-1。
(4)综合上面三个实验,该混合物的水溶液中一定不存在的离子是(填离子符号)。
(5)某同学通过分析认为该溶液中一定存在K+,他的理由是。
A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D、E是第四周期元素,其中D原子核外未成对电子数在同周期中最多。E原子最外层只有1个电子,其余各层均排满。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为,1mol该分子中含有 键的物质的量为。
键的物质的量为。
(3)基态D原子的外围电子排布式为。DO2Cl2熔点:-96.5℃,沸点:117℃,则固态DO2Cl2属于晶体。
(4)E的氢化物的晶胞结构如图所示
其化学式是。
(本题共12分)
l,6-己二酸(G)是合成尼龙(一种高分子合成纤维)的主要原料之一,可用含六个碳原子的有机化合物氧化制备。A通过氧化反应制备G的合成路线如下(可能的反应中间物质为B、C、D、E和F)。
完成下列填空:
46.化合物A中含碳87.8%,其余为氢,A的名称为___________________。
47.B到C的反应类型为______________。
48.F的结构简式为______________________________。
49.在上述中间物质中,不同环境氢原子最多的是_________,最少的是_________(填化合物代号)。
50.由G合成尼龙的化学方程式为_________________________________________________
51.写出由A通过两步反应制备1,3-环己二烯的合成路线。
(本题共10分)
化合物A有稳定性好、抗氧化能力强的特点,其结构如
分子中片段X对A的性能起了重要作用,为研究X的结构,将化合物A在一定条件下水解只得到B( )和C。经测定确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,跟NaHCO3溶液反应有CO2产生。
)和C。经测定确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,跟NaHCO3溶液反应有CO2产生。
完成下列填空:
42.化合物B能发生下列哪种类型的反应_________________
A.取代反应B.加成反应C.缩聚反应 D.氧化反应
43.化合物C能经下列反应得到G(分子式为C8H6O2,分子内含五元环)。
已知:
化合物C的结构简式为____________________________________。
44.反应F→G的化学方程式为___________________________________________________
45.化合物E有多种同分异构体,1H核磁共振谱图表明,其中某些同分异构体含有苯环,且苯环上有两种不同化学环境的氢,写出这些同分异构体中任意三种的结构简式是____________________