通过煤的气化和液化,使碳及其化合物得以广泛应用。
I.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向1L恒容密闭容器中充人CO和H2O(g),800℃时测得部分数据如下表。
| t/min |
0 |
1 |
2 |
3 |
4 |
| n(H2O)/mol |
0.600 |
0.520 |
0.450 |
0.350 |
0.350 |
| n(CO)/mol |
0.400 |
0.320 |
0.250 |
0.150 |
0.150 |
则该温度下反应的平衡常数K= 。
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1 H2,
此时υ(正) υ(逆) (填“>” “="”" 或 “<”)。
II.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283 kJ·mol-1、286 kJ·mol-1、726 kJ·mol-1'。
(3)利用CO、H2合成液态甲醇的热化学方程式为 。
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响 。
III。为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示: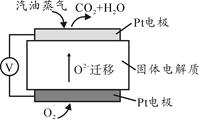
一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2—。
(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式 。
(6)已知一个电子的电量是1.602×10—19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH g。
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一。
(7)将CO2转化成有机物可有效地实现碳循环。如:
a.6CO2+6H2O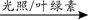 C6H12O6+6O2
C6H12O6+6O2
b.2CO2 + 6H2 C2H5OH +3H2O
C2H5OH +3H2O
c.CO2 + CH4 CH3COOH
CH3COOH
d.2CO2 + 6H2 CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
以上反应中,最节能的是 ,反应c中理论上原子利用率为 。
无色透明溶液中可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-,取该溶液进行如下实验:①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取原溶液少许,加铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色;
③取原溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取原溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。请回答下列问题:
(1)根据上述实验判断原溶液中上述离子肯定存在的是,
肯定不存在的是。
(2)写出与②③两个实验有关的离子方程式:
②,
③。
(5分)某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)(2分)硫酸铜溶液可以加快氢气生成速率的原因。
(2)(1分)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是。
(3)(2分)要加快上述实验中气体产生的速率,还可采取的措施有(答两种):;。
(10分)臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是和(填分子式)。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为 0.021 6 mol/L。
①pH增大能加速O3分解,表明对O3分解起催化作用的是。
②在30℃、pH=4.0条件下,O3的分解速率为。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为(填字母代号)。
A.40 ℃、pH=3.0B.10 ℃、pH=4.0C.30 ℃、pH=7.0
(3分)已知:①Fe2O3(s)+ C(s)
C(s)
 CO2(g)+2Fe(s) ΔH="+234.1" kJ·mol-1
CO2(g)+2Fe(s) ΔH="+234.1" kJ·mol-1
②C(s)+O2(g) CO2(g)ΔH="-393.5" kJ·mol-1
CO2(g)ΔH="-393.5" kJ·mol-1
则Fe(s)与O2反应生成Fe2O3的热化学方程式是
(7*1分)某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:
(1)操作①的名称是,操作②的名称是。
(2)试剂a是,试剂b是,固体B是。(填化学式)
(3)加入试剂a所发生的离子方程式为:。
加入试剂b所发生的离子方程式为:。