实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应。
| 实验编号 试剂 |
A |
B |
C |
| 10% H2O2/mL |
20.0 |
V1 |
V2 |
| 2mol/L FeCl3/ mL |
0 |
5.0 |
10.0 |
| H2O/ mL |
V3 |
V4 |
0 |
按要求回答下列问题:
(1)欲用右图装置来比较该反应的反应速率快慢,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测 推(计)算反应速率。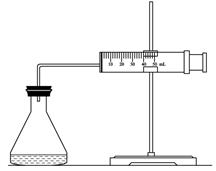
(2)为实现实验目的,则V1= ,V2= ;
V3= ,V4= 。
(3)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是 (填“实验编号”)
(4)已知Fe3+催化H2O2分解的机理可分两步反应进行,其中第一步反应为:2Fe3+ + H2O2 ==2Fe2+ + O2↑+ 2H+,则第二步反应的离子方程式为:
。
如图是分离混合物时常用的仪器
(1)写出下列仪器的名称:
AB(各1分)
(2)欲分离下列混合物须使用的仪器是(填写所代表仪器的字母):
①欲分离互不相溶的两种液态物质,须使用
②欲分离悬浮于液体中的固体物质,须使用
③欲分离液态混合物中沸点不同的物质,须使用
下图表示配制 100 mL 0.100 mol·L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题:
(1)用托盘天平称取Na2CO3·10H2O的质量是。
(2)步骤E中将一玻璃仪器上下颠倒数次,该仪器的名称是。
(3)步骤B通常称为转移,步骤A通常称为。
(4)将上述实验步骤A→F按实验过程先后次序排列。
如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(品红溶液;一种常见的红色溶液)C(KBr溶液)D(碘化钾-淀粉溶液)E(水)H(紫色石蕊试液)
(1)A是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其化学反应方程式是:
(2)实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让氯气充满整个装置,再点燃G处酒精灯,回答下列问题:
下列装置中的现象是B;D
请写出C中的化学方程式
(3)在G装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,一种产物能使H处紫色石蕊试液变红,另一产物能使澄清石灰水变浑浊,写出G中的反应的化学方程式。
(4)在H处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是。
(5)G处反应完毕后关闭分液漏斗旋塞,移去酒精灯,但由于余热的作用,A处仍有氯气产生,此时应该怎样操作;装置Ⅰ中的现象是。
实验室用氢氧化钠固体配制1.00mol/L的NaOH溶液500mL,回答下列问题:
(1)实验步骤为:、称量、溶解(冷却)、、、定容、摇匀、装瓶
(2)必须用到的仪器为(选择以下编号):
①托盘天平、②量筒、③烧杯、④试管、⑤玻璃棒、⑥500ml容量瓶、⑦胶头滴管
(3)下列操作对所配溶液的浓度有何影响?(填偏高、偏低、无影响)
①在未降至室温时,立即将溶液转移至容量瓶定容:
②读数时俯视读数:
草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:
称取Wg草酸晶体,配成100.00mL无色水溶液。量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L-1的KMnO4溶液滴定。试回答:
(1)滴定时所发生反应的化学方程式为
(2)草酸是二元弱酸,则草酸的电离方程式为请从“电离平衡”的角度解释:为什么草酸的第二步电离比第一步难
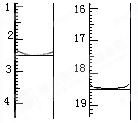
图I表示100mL量筒中液面的位置,A与B,B与C刻度间相差10mL,如果刻度A为30,量筒中液体的体积是___________mL。图II表示25mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)_____________。
| A.是amL | B.是(25-a)mL |
| C.一定大于amL | D.一定大于(25-a)mL |
(3)实验中,标准液KMnO4溶液应装在_______式滴定管中。若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的x值会_____(偏大、偏小、无影响)达到滴定终点,溶液由色变为色;
(4)在滴定过程中若用amol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为_______mol·L-1;
(5)若测得x=2,称取某二水合草酸晶体0.1200 g,加适量水完全溶解,然后用0.02000 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中二水合草酸的质量分数为。